题目内容
【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
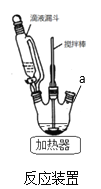
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
【答案】 球形冷凝管或冷凝管 提取产物和未反应的原料 使Fe3+转化为氢氧化铁沉淀 铁粉和Fe(OH)3 与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离 对甲基苯胺盐酸盐与氢氧化钠作用可使对甲苯胺重新游离出来 A
【解析】(1)根据流程图,对硝基甲苯与铁粉和盐酸反应时,需要回流装置,因此反应装置中缺少冷凝管,故答案为:冷凝管;
(2)对甲基苯胺和对硝基甲苯易溶于苯,步骤②中加苯,可以提取产物和未反应的原料,达到与无机试剂的分离,硝基具有比较强的氧化性,能够将铁氧化为铁离子,步骤②中用5%碳酸钠溶液调pH=7~8,可以使Fe3+转化为氢氧化铁沉淀,故答案为:提取产物和未反应的原料;使Fe3+转化为氢氧化铁沉淀;
(3)根据(2)的分析,步骤③得到的固体物质中含有未反应的铁粉和生成的氢氧化铁沉淀,故答案为:铁粉和Fe(OH)3;
(4)抽滤后的液体中含有产物对甲基苯胺,步骤④中加入盐酸,可以与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离,故答案为:与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离;
(5)步骤⑤中通过加入氢氧化钠溶液,氢氧化钠能够与对甲基苯胺盐酸盐作用生成对甲基苯胺,使对甲基苯胺结晶析出,故答案为:对甲基苯胺盐酸盐与氢氧化钠作用可使对甲苯胺重新游离出来;
(6)对甲基苯胺微溶于水,易溶于乙醇、苯,因此步骤⑥中,最合适的洗涤剂为水,故选A。

【题目】工业上可用粗硅(含铁、铝、硼、磷等杂质)与干燥的HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅。
有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | 33.0 | — |
熔点/℃ | -70.0 | -107.2 | — | — | -126.5 | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4,提纯SiHCl3可采用
___________的方法
(2)实验室也可用SiHCl3与过量干燥的H2反应制取纯硅,装置如下图所示(加热和夹持装置略去):

①装置B中的试剂是___________,装置C需水浴加热,目的是 ____________________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是_____________。