题目内容
在下列操作过程中,发生的反应能用离子方程式Al3++3AlO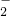 +6H2O=4Al(OH)3↓表示的是
+6H2O=4Al(OH)3↓表示的是
- A.向铝盐溶液中不断滴加NaOH溶液
- B.向氨水中不断滴加铝盐溶液
- C.向铝盐溶液中不断滴加小苏打溶液
- D.向铝盐溶液中不断滴加NaAlO2溶液
D
分析:可溶性铝盐和可溶性偏铝酸盐发生相互促进水解的离子反应为Al3++3AlO2-+6H2O=4Al(OH)3↓,以此来解答.
解答:A.向铝盐溶液中不断滴加NaOH溶液,发生Al3++3OH-=Al(OH)3↓,故A不选;
B.向氨水中不断滴加铝盐溶液,发生Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B不选;
C.向铝盐溶液中不断滴加小苏打溶液,发生Al3++3HCO3-=Al(OH)3↓+3CO2↑,故C不选;
D.向铝盐溶液中不断滴加NaAlO2溶液,发生Al3++3AlO2-+6H2O=4Al(OH)3↓,故D选;
故选D.
点评:本题考查离子反应的书写,明确发生的化学反应是解答的关键,注意离子反应的书写方法即可解答,侧重水解反应的考查,题目难度中等.
分析:可溶性铝盐和可溶性偏铝酸盐发生相互促进水解的离子反应为Al3++3AlO2-+6H2O=4Al(OH)3↓,以此来解答.
解答:A.向铝盐溶液中不断滴加NaOH溶液,发生Al3++3OH-=Al(OH)3↓,故A不选;
B.向氨水中不断滴加铝盐溶液,发生Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B不选;
C.向铝盐溶液中不断滴加小苏打溶液,发生Al3++3HCO3-=Al(OH)3↓+3CO2↑,故C不选;
D.向铝盐溶液中不断滴加NaAlO2溶液,发生Al3++3AlO2-+6H2O=4Al(OH)3↓,故D选;
故选D.
点评:本题考查离子反应的书写,明确发生的化学反应是解答的关键,注意离子反应的书写方法即可解答,侧重水解反应的考查,题目难度中等.

练习册系列答案
相关题目
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入大量瓷环。下列有关说法中,不正确的是
 |
A.从①处通入含SO3的混合气体,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的尾气中含量最高的气体是SO2,所以不可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的“发烟”硫酸


