题目内容
工业上常用强的氧化剂处理钢件,使其表面形成致密、光滑的四氧化三铁氧化膜,以增强钢铁的抗腐蚀能力,这种处理叫做“发蓝”或“发黑”. 其过程主要有:去污、酸洗、氧化处理、皂化、热水煮沸、检查等步骤.钢件表面氧化过程可分为三个阶段:①Fe→Na2FeO2;②Na2FeO2→Na2Fe2O4;③Na2FeO2+Na2Fe2O4→Fe3O4.请回答以下问题:
(1)酸洗时常用稀硫酸除去表面的铁锈,写出除锈时的离子方程式 .
(2)将钢件浸入130℃以上含有NaNO2和NaOH溶液中,逸出一种能使湿润的红色石蕊试纸变蓝的气体,片刻后铁片表面变黑.请写出该气体的电子式 ,氧化处理时第一阶段反应的化学方程式为 .
(3)在发黑的过程中可能会形成有害的氧化铁红色胶状物Fe2O3?H2O,其原因可能是
.钢件能否长时间耐腐蚀是衡量“发黑”效果的重要指标,请设计检验钢件表面处理效果的实验方案 .
(4)氧化处理中产生大量含NO2-和OH-?的废水,某同学设计以下方案处理废水:
操作1:调节溶液pH接近中性
操作2:加入适量的氯化铵溶液并加热至沸,产生大量气体,该气体为大气的主要成分
①操作1和操作2的顺序能否对调?请说明理由 .
②为减轻处理后的产物对环境造成二次污染,下列适合处理含NO2-废水的物质是 .
A.O3B.KIC.K2Cr2O7D.NaClO
③经处理后,水中NO2-浓度降为5.0×10-4mol?L-1,取该溶液1mL于试管中,滴加2滴(约0.1mL)2.0mol?L-1的AgNO3溶液,通过计算判断能否产生沉淀 .[已知KSP(AgNO2)=5.8×10-4,不考虑其他离子的反应].
(1)酸洗时常用稀硫酸除去表面的铁锈,写出除锈时的离子方程式
(2)将钢件浸入130℃以上含有NaNO2和NaOH溶液中,逸出一种能使湿润的红色石蕊试纸变蓝的气体,片刻后铁片表面变黑.请写出该气体的电子式
(3)在发黑的过程中可能会形成有害的氧化铁红色胶状物Fe2O3?H2O,其原因可能是
(4)氧化处理中产生大量含NO2-和OH-?的废水,某同学设计以下方案处理废水:
操作1:调节溶液pH接近中性
操作2:加入适量的氯化铵溶液并加热至沸,产生大量气体,该气体为大气的主要成分
①操作1和操作2的顺序能否对调?请说明理由
②为减轻处理后的产物对环境造成二次污染,下列适合处理含NO2-废水的物质是
A.O3B.KIC.K2Cr2O7D.NaClO
③经处理后,水中NO2-浓度降为5.0×10-4mol?L-1,取该溶液1mL于试管中,滴加2滴(约0.1mL)2.0mol?L-1的AgNO3溶液,通过计算判断能否产生沉淀
分析:(1)铁锈的主要成分为Fe2O3?xH2O;
(2)能使湿润的红色石蕊试纸变蓝的气体为氨气,由①Fe→Na2FeO2和(2)中所给物质可以得出此反应的反应物和产物,配平即得方程式;
(3)亚铁酸钠、铁酸钠均属于强碱弱酸盐,在水溶液中均可以发生水解;通过观察化学反应速率来确定钢件的耐腐蚀性;
(4)①NH4+大量与OH-反应逸出污染大气的气体;
②NO2-具有很强的还原性,要从强氧化性物质中找,Cr3+属于重金属离子;
③比较离子浓度熵与Ksp的大小.
(2)能使湿润的红色石蕊试纸变蓝的气体为氨气,由①Fe→Na2FeO2和(2)中所给物质可以得出此反应的反应物和产物,配平即得方程式;
(3)亚铁酸钠、铁酸钠均属于强碱弱酸盐,在水溶液中均可以发生水解;通过观察化学反应速率来确定钢件的耐腐蚀性;
(4)①NH4+大量与OH-反应逸出污染大气的气体;
②NO2-具有很强的还原性,要从强氧化性物质中找,Cr3+属于重金属离子;
③比较离子浓度熵与Ksp的大小.
解答:解:(1)铁锈的主要成分为Fe2O3?xH2O,铁锈溶液稀硫酸之后发生Fe2O3+6H+=2Fe2++3H2O,故答案为:Fe2O3+6H+=2Fe2++3H2O;
(2)能使湿润的红色石蕊试纸变蓝的气体为碱性气体,NaNO2在氧化处理时第一阶段反应中作还原剂,故此气体必为氨气,其电子式为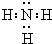 ;结合Fe→Na2FeO2可知,此反应的反应物为NaOH以及还原剂Fe、氧化剂NaNO2,生成物为Na2FeO2和氨气和水,配平得3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O,
;结合Fe→Na2FeO2可知,此反应的反应物为NaOH以及还原剂Fe、氧化剂NaNO2,生成物为Na2FeO2和氨气和水,配平得3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O,
故答案为: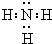 ;3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O;
;3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O;
(3)亚铁酸钠、铁酸钠均属于强碱弱酸盐,在水溶液中均可以发生水解,水解的产物通过氧化还原反应、分解反应等反应最终形成有害的氧化铁红色胶状物;通过观察能与铁发生化学反应的物质(如硫酸铜溶液、稀盐酸等)和钢板反应的快慢来判断钢材耐腐蚀能力,出现较明显现象时间越长,说明耐腐蚀性能越好,
故答案为:亚铁酸钠、铁酸钠发生水解,最终形成Fe2O3?H2O;取一小块处理后的钢件,在其表面上滴加几滴硫酸铜溶液,若出现红色物质(斑点)所需时间越长,表示其氧化膜耐腐蚀性越好;
(4)①铵根离子与氢氧根离子反应生成氨气,氨气是一种具有刺激性气味的气体,如果操作1和操作2的顺序对调,则会污染空气,故答案为:不能,若对调,则NH4+大量与OH-反应逸出氨气;
②NO2-具有很强的还原性,需要加氧化剂除掉,故排除B,在选项A、C、D三种强氧化剂中,K2Cr2O7被NO2-还原为重金属离子Cr3+造成二次污染,故选:AD;
③c(Ag+)?c(NO2-)=
×2.0×
×5.0×10-4=0.83×10-4<KSP(AgNO2)=5.8×10-4,此时溶液不饱和,所以没有沉淀生成,
故答案为:c(Ag+)?c(NO2-)=
×2.0×
×5.0×10-4=0.83×10-4<5.8×10-4,所以没有沉淀生成.
(2)能使湿润的红色石蕊试纸变蓝的气体为碱性气体,NaNO2在氧化处理时第一阶段反应中作还原剂,故此气体必为氨气,其电子式为
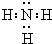 ;结合Fe→Na2FeO2可知,此反应的反应物为NaOH以及还原剂Fe、氧化剂NaNO2,生成物为Na2FeO2和氨气和水,配平得3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O,
;结合Fe→Na2FeO2可知,此反应的反应物为NaOH以及还原剂Fe、氧化剂NaNO2,生成物为Na2FeO2和氨气和水,配平得3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O,故答案为:
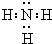 ;3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O;
;3Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2O;(3)亚铁酸钠、铁酸钠均属于强碱弱酸盐,在水溶液中均可以发生水解,水解的产物通过氧化还原反应、分解反应等反应最终形成有害的氧化铁红色胶状物;通过观察能与铁发生化学反应的物质(如硫酸铜溶液、稀盐酸等)和钢板反应的快慢来判断钢材耐腐蚀能力,出现较明显现象时间越长,说明耐腐蚀性能越好,
故答案为:亚铁酸钠、铁酸钠发生水解,最终形成Fe2O3?H2O;取一小块处理后的钢件,在其表面上滴加几滴硫酸铜溶液,若出现红色物质(斑点)所需时间越长,表示其氧化膜耐腐蚀性越好;
(4)①铵根离子与氢氧根离子反应生成氨气,氨气是一种具有刺激性气味的气体,如果操作1和操作2的顺序对调,则会污染空气,故答案为:不能,若对调,则NH4+大量与OH-反应逸出氨气;
②NO2-具有很强的还原性,需要加氧化剂除掉,故排除B,在选项A、C、D三种强氧化剂中,K2Cr2O7被NO2-还原为重金属离子Cr3+造成二次污染,故选:AD;
③c(Ag+)?c(NO2-)=
| 0.1 |
| 1.1 |
| 1 |
| 1.1 |
故答案为:c(Ag+)?c(NO2-)=
| 0.1 |
| 1.1 |
| 1 |
| 1.1 |
点评:本题以元素及其化合物为载体,考查氧化还原反应原理、水解原理,并渗透着环保意识,其中方程式书写和计算是易失分点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目