题目内容
等物质的量的下列物质①甲醇(CH3OH) ②乙醇(CH3CH2OH) ③乙二醇(![]() ) ④丙三醇(
) ④丙三醇( ),用物质的编号填空:
),用物质的编号填空:
(1)在空气中完全燃烧时,消耗氧气的质量由多到少的顺序________,反应中生成CO2的体积(相同状况)由小到大的顺序________.
(2)分别与足量的金属钠反应,放出H2的体积(相同状况)由少到多的顺序是________.
答案:
解析:
解析:
|
答案:(1)④>②>③>① ①<②=③<④ (2)①=②<③<④ 解析:(1)耗氧计算可先将四种物质改写成CxHy·nH2O的形式. 甲醇CH2·H2O 乙醇C2H4·H2O 乙二醇C2H2·2H2O 丙三醇C3H2·3H2O 可判断1 mol四种物质完全燃烧消耗氧气分别为1.5 mol、3 mol、2.5 mol、3.5 mol,故顺序为④②③①.生成CO2的体积只与碳原子数有关,与H、O原子个数无关,故顺序为①<②=③<④. (2)与足量金属钠反应生成H2体积与原分子中羟基个数有关,羟基数目越多生成H2的体积越大,故由少到多的顺序为①=②<③<④. |

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
在容积为2L的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图1、图2所示.下列说法正确的是( )
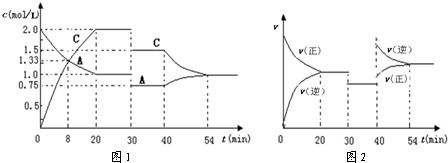

| A、0~20min用A物质表示反应的平均速率为0.05mol?L-1?min-1 | B、该反应的正反应为吸热反应 | C、x=1,且30min时改变的反应条件是减压 | D、在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
