题目内容
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3.下列对这四种气体的描述不正确的是
A.体积②>③>①>④B.密度②>③>④>①
C.质量③>②>①>④D.氢原子个数①>③>④>②
【答案】C
【解析】
A项、标准状况下,CH4的体积为6.72L,3.01×1023个HCl分子的体积为![]() ×22.4L/mol=11.2L,13.6gH2S的体积为
×22.4L/mol=11.2L,13.6gH2S的体积为![]() ×22.4L/mol=8.96L,0.2molNH3的体积为0.2mol×22.4L/mol=4.48L,则体积的大小顺序为②>③>①>④,故A正确;
×22.4L/mol=8.96L,0.2molNH3的体积为0.2mol×22.4L/mol=4.48L,则体积的大小顺序为②>③>①>④,故A正确;
B项、气体的摩尔质量与密度成正比,摩尔质量越大,密度越大,CH4、HCl、H2S、NH3的摩尔质量分别为16g/mol、36.5 g/mol、34 g/mol、17 g/mol,则气体密度的大小顺序为②>③>④>①,故B正确;
C项、6.72LCH4的质量为![]() ×16g/mol =4.8g,3.01×1023个HCl分子的质量为
×16g/mol =4.8g,3.01×1023个HCl分子的质量为![]() ×36.5g/mol =18.25g, H2S的质量为13.6g,0.2molNH3的质量为0.2mol×17 g/mol=3.4g,则质量的大小顺序为②>③>①>④,故C错误;
×36.5g/mol =18.25g, H2S的质量为13.6g,0.2molNH3的质量为0.2mol×17 g/mol=3.4g,则质量的大小顺序为②>③>①>④,故C错误;
D项、6.72LCH4含有氢原子的物质的量为![]() ×4=1.2mol,3.01×1023个HCl分子含有氢原子的物质的量为
×4=1.2mol,3.01×1023个HCl分子含有氢原子的物质的量为![]() ×1=0.5mol,13.6gH2S含有氢原子的物质的量为
×1=0.5mol,13.6gH2S含有氢原子的物质的量为![]() ×2=0.8mol,0.2molNH3含有氢原子的物质的量为0.2mol×3=0.6mol,则氢原子个数大小顺序为①>③>④>②,故D正确;
×2=0.8mol,0.2molNH3含有氢原子的物质的量为0.2mol×3=0.6mol,则氢原子个数大小顺序为①>③>④>②,故D正确;
故选C。

【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
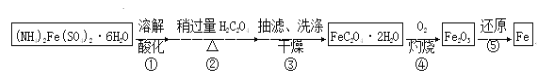
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→________→c→关抽气泵。
a.转移固液混合物;b.关活塞A;c.开活塞A;d.确认抽干;e.加洗涤剂洗涤
抽滤和普通过滤相比,优点是___________________________________________。
(3) 称取一定量的FeC2O4·2H2O试样,用硫酸溶解,
采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n( | 试样中FeC2O4·2H2O的质量分数 |
9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是____________________。
(4)实现步骤④必须用到的两种仪器是____________________
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);
该步骤的化学方程式是______________________________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________________________。
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H=-1077 kJ·mol-1。
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N |
| O-H |
E/(kJ·mol-1) | 390 | 190 | 946 | 460 |
①使1 mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是________________。
②下列能说明2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H 达平衡状态的是________
a.混合气体的平均相对分子质量不变 b.V(N2)=3V( N2O4)
c.N2H4的质量保持不变 d. △H不再变化
(2)N2O4与NO2之间存在反应N2O4(g) ![]() 2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。
2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。

①由图推测该反应的△H_______0(填>”或“<”),理由为____________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,则该温度下反应的平衡常数Kp=________________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)电解NO2制备NH4NO3,其工作原理如下图所示。

①阴极的电极反应式为____________________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物——物质A,则A的化学式为________________。