题目内容
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
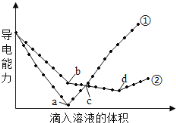
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
【答案】D
【解析】
分析特殊点,a点为硫酸和氢氧化钡恰好反应的点,导电性几乎为零,b点为氢氧化钡和硫酸氢钠反应时钡离子恰好沉淀的点,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点。
A. 根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为![]() 溶液和硫酸的反应,则曲线②为
溶液和硫酸的反应,则曲线②为![]() 溶液和硫酸氢钠溶液的反应,故A正确;
溶液和硫酸氢钠溶液的反应,故A正确;
B.根据图知,a点为![]() 溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
C. a点为![]() 溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
D.c点加入硫酸和硫酸氢钠的物质的量相等,故加入氢离子的量不相等,故氢氧根的量不相等,D错误;
答案选D。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。