题目内容
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
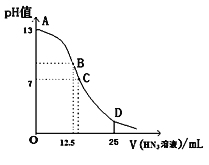
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
【答案】B
【解析】
A.HN3是一元弱酸,与NaOH等物质的量反应得到的盐是强碱弱酸盐,溶液显碱性,所以滴定时要选择在碱性条件下变色的指示剂酚酞,不能使用酸性范围变色的指示剂甲基橙,A错误;
B.在B点时NaOH与HN3恰好发生中和反应产生NaN3,根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(N3-),由于NaOH、HN3的体积已知,所以c(Na+)=(25mL× 0.1 mol/L)÷(25+12.5)mL=0.067mol/L,此时溶液的pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,可得c(N3-)=c(Na+)+c(H+)-c(OH-)= c(Na+)+10-8-10-6,再根据物料守恒可得c(HN3)+ c(N3-)=c(Na+),所以c(HN3)=(10-6~10-8 )mol/L,B正确;
C. D点时HN3的物质的量是NaOH的2倍,溶液为NaN3、HN3等物质的量关系混合,此时溶液中存在HN3的电离作用和N3-的水解作用,根据图示可知此时溶液显酸性,说明HN3的电离作用大于N3-的水解作用,所以c(N3-)>c(Na+),HN3由于电离而消耗,因此c(Na+)>c(HN3),因此溶液中微粒浓度关系为c(N3-)>c(Na+)>c(HN3),C正确;
D.在A点溶液为NaOH溶液,NaOH是碱,抑制水的电离,随着HN3的加入,溶液的碱性逐渐减弱,水电离程度逐渐增大,当到B点时酸碱恰好中和,水电离程度达到最大值,后再向溶液中加入HN3,这时随着酸的加入,溶液逐渐变为酸性,酸对水的电离起抑制作用,水电离程度由逐渐减小,因此沿曲线A→B→C的过程中,由水电离产生的c(OH-)先逐渐增大到B点时最大,后又逐渐减少,D错误;
故合理选项是B。