题目内容
【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。

(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。
【答案】Mg(OH)2 能安静燃烧、产生淡蓝色火焰,气体成分为氢气 稀盐酸(合理均可) 产生气泡,沉淀全部溶解 CO32— 3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3] NaHCO3溶液中存在如下平衡:HCO3—![]() H++CO32—、H2O
H++CO32—、H2O![]() H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均向右移动。故Mg与饱和NaHCO3溶液反应产生大量H2
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均向右移动。故Mg与饱和NaHCO3溶液反应产生大量H2
【解析】
本题考查常见离子的检验方法和实验现象的记忆,从质量守恒定律角度进行计算及影响电离、水解平衡的因素。
(1)依据猜测可知白色不溶物不可能是MgCO3或xMgCO3·yMg(OH)2,联想可得猜测1为Mg(OH)2;
(2)迅速反应,产生大量气泡和白色不溶物,说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色沉淀;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子,故答案为:能安静燃烧、产生淡蓝色火焰,该气体为氢气;稀盐酸;产生气泡,沉淀全部溶解;CO32-。
(3)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设生成2.64g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X2.64g
解得X=5.04g,所以含有氢氧化镁质量为:6.20g-5.04g=1.16g;
碳酸镁和氢氧化镁物质的量之比为:![]() :
:![]() =3:1,故化学式为3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]。
=3:1,故化学式为3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]。
(4)HCO3—存在电离平衡和水解平衡:HCO3—![]() H++CO32—、HCO3—+H2O
H++CO32—、HCO3—+H2O![]() H2CO3+OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均正向移动。故Mg与饱和NaHCO3溶液反应产生大量H2
H2CO3+OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均正向移动。故Mg与饱和NaHCO3溶液反应产生大量H2

【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 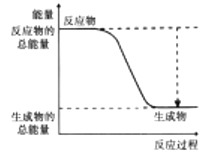 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。



