题目内容
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
Ⅱ:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
(1)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图.
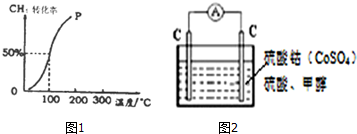
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
(2)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的
,其他条件不变,对平衡体系产生的影响是 (填字母序号)
A.平衡常数K增大
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c
减小
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
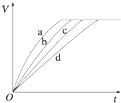
若图2装置中的电源为甲醇一空气-KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OH-向 极移动.净化合1mol甲醇的水,燃料电池转移电子 mol.写出净化甲醇的离子方程式 .
Ⅰ:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
Ⅱ:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
(1)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图.

假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
(2)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
A.平衡常数K增大
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c
| c(H2) |
| c(CH3OH) |
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
若图2装置中的电源为甲醇一空气-KOH溶液的燃料电池,则电池正极的电极反应式:
考点:反应速率的定量表示方法,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;再根据v(H2)=
进行计算;
(2)其他条件不变,平衡后将容器的容积压缩到原来的
,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
(3)负极发生氧化反应,则负极带正电,故OH-向负极移动;正极发生还原反应,氧气在正极得到电子;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;再根据关系式CH3OH~6e-进行计算.
| △c |
| t |
(2)其他条件不变,平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
(3)负极发生氧化反应,则负极带正电,故OH-向负极移动;正极发生还原反应,氧气在正极得到电子;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;再根据关系式CH3OH~6e-进行计算.
解答:
解:(1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
则v(H2)=
=0.003 mol?L-1?min-1,
故答案为:0.003 mol?L-1?min-1;
(2)A.平衡常数只受温度影响,温度不变,平衡常数不变,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡c
减小,故D正确;
故答案为:CD;
(3)正极发生还原反应,氧气在正极得到电子,电极反应式为:O2+2H2O+4e-=4OH-,负极发生氧化反应,故负极带正电,故OH-向负极移动;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;由CH3OH~6e-可知:净化含1mol甲醇的水,燃料电池转移6mol电子,
故答案为:O2+2H2O+4e-=4OH-,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
则v(H2)=
| ||
| 5min |
故答案为:0.003 mol?L-1?min-1;
(2)A.平衡常数只受温度影响,温度不变,平衡常数不变,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡c
| c(H2) |
| c(CH3OH) |
故答案为:CD;
(3)正极发生还原反应,氧气在正极得到电子,电极反应式为:O2+2H2O+4e-=4OH-,负极发生氧化反应,故负极带正电,故OH-向负极移动;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;由CH3OH~6e-可知:净化含1mol甲醇的水,燃料电池转移6mol电子,
故答案为:O2+2H2O+4e-=4OH-,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评:本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池等,题目难度较大.

练习册系列答案
相关题目
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列研究目的和示意图相符的是( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
| A、A | B、B | C、C | D、D |
可逆反应mA(气)+nB?pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
| A、增大压强,平衡不移动,说明(m+n)一定等于(p+q) |
| B、升高温度,A的转化率减小,说明正反应是吸热反应 |
| C、若增加B的量,平衡体系颜色加深,说明B必是气体物质 |
| D、若B是气体,增加A的量,A、B转化率都一定增大 |
下列实验操作中错误的是( )
| A、进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
近几年冬天,全国多个地区发生持续大雾天气;从2012年开始,我国多地开始“PM2.5”数据监测.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可吸入肺颗粒物.下列有关说法中,错误的是 ( )
| A、雾属于胶体,能产生丁达尔效应 |
| B、持续大雾天气给农业生产、交通运输等带来很大影响 |
| C、大雾的形成与汽车的尾气排放有很大关系 |
| D、“PM2.5”悬浮在空气中形成胶体,严重危害人体健康 |
体积均为200mL浓度均为1mol/L的稀盐酸和氢氧化钠溶液中分别加入相同质量的铝,充分反应后生成气体在相同条件下的体积比为2:3.则下列说法正确的是( )
| A、盐酸过量,氢氧化钠不足 |
| B、氢氧化钠过量,盐酸不足 |
| C、两容器中投入的铝的质量为2.7g |
| D、条件不足,无法判断 |
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )
 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?2C(g);△H<0达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?2C(g);△H<0达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )