题目内容
把碳酸氢钠溶液滴入下列溶液中,能反应并放出气体的是
- A.NaOH溶液
- B.石灰水
- C.硫酸氢钠溶液
- D.氯化铝溶液
CD
碳酸氢钠和氢氧化钠反应生成的是碳酸钠和水;碳酸氢钠和石灰水反应生成的是碳酸钙;硫酸氢钠能电离出氢离子,和碳酸氢钠反应生成CO2;氯化铝和碳酸氢钠水解相互促进,生成氢氧化铝和CO2,所以答案选CD。
碳酸氢钠和氢氧化钠反应生成的是碳酸钠和水;碳酸氢钠和石灰水反应生成的是碳酸钙;硫酸氢钠能电离出氢离子,和碳酸氢钠反应生成CO2;氯化铝和碳酸氢钠水解相互促进,生成氢氧化铝和CO2,所以答案选CD。

练习册系列答案
相关题目
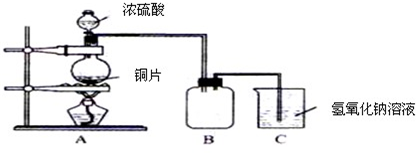
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H 0(“>”、“<”、“=”).前2h内的平均反应速率v(N2)= ,在该温度下,反应的平衡常数K= .据此你认为将该反应从理论转化为现实的最重要的研究方向是 .

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.