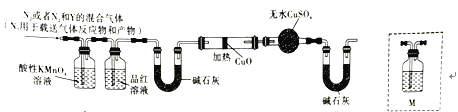
题目内容
【题目】(1)给定条件下的下列四种物质:①常温下112mL液态水,②含有40mol电子的NH3, ③含有16NA个共价键的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00g/L,则该气体中氧气和甲烷的体积比为________。
(3)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL, 则所得溶液中溶质物质的量浓度是________ mol/L 。
(4)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
【答案】 ①>②>③>④ 2:3 1000ρv/(17v+22400) 2mol/L
【解析】(1)根据N=nNA判断,即物质的量越多,分子数越多;
(2)根据标况下混合气体的密度计算摩尔质量,然后利用摩尔质量的含义解答;
(3)根据c=n/V计算;
(4)根据氢氧化钠的物质的量计算氢离子的物质的量,利用氯化钡计算硫酸根离子的物质的量,然后利用电荷守恒计算氯离子浓度。
(1)①常温下112mL液态水,质量为112g,物质的量为112g÷18g/mol=6.2mol;②含有40mol电子的NH3的物质的量为40mol÷10=4mol;③1个乙醇分子含有8个共价键,含有16NA个共价键的乙醇的物质的量为2mol;④4g氦气的物质的量为1mol,物质的量越大,含有的分子数越多,则上述物质中所含分子数目由多到少的顺序为①>②>③>④;
(2)混合气体的平均摩尔质量为1.00g/L×22.4L/mol=22.4g/mol,令氧气、甲烷的物质的量分别为xmol、ymol,则(32x+16y)/(x+y)=22.4,整理可得x:y=2:3,即该气体中氧气和甲烷的体积比为2:3;
(3)标准状况下VL氨气的物质的量为V/22.4 mol,质量为17V/22.4 g,溶解在1L水中,所得溶液的质量为17V/22.4g+1000g,体积为:![]() ,因此该溶液的溶质的物质的量浓度为:
,因此该溶液的溶质的物质的量浓度为:![]() ;
;
(4)混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,一份加氢氧化钠溶液时发生反应H++OH-=H2O,由方程式可知每份溶液中n(H+)=n(OH-)=0.2mol;另一份加BaCl2溶液发生反应Ba2++SO42-=BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=0.05mol,由电荷守恒可知每份中n(H+)=2n(SO42-)+n(Cl-),故每份中溶液n(Cl-)=0.2mol-2×0.05mol=0.1mol,因此原溶液中c(Cl-)=0.1mol÷0.05L=2mol/L。

【题目】实验室以含有Ca2+、Mg2+、Cl-、SO![]() 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
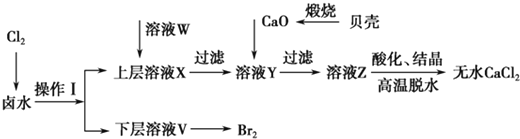
(1)操作Ⅰ使用的试剂是____________,所用主要仪器的名称是________。
(2)加入溶液W的目的是______________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是____________。酸化溶液Z时,使用的试剂为__________。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。

(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3的酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于___________________________。用一个化学方程式表示H2SO3酸性强于H2CO3: __________________。
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。