题目内容
铁氧磁体法处理含Cr2O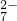 的废水的原理如下:向含Cr2O
的废水的原理如下:向含Cr2O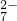 的酸性废水中加入FeSO4?7H2O,将Cr2O
的酸性废水中加入FeSO4?7H2O,将Cr2O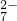 还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O
还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O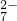 的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是
的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是
- A.x=0.5,a=8
- B.x=0.5,a=10
- C.x=1.5,a=8
- D.x=1.5,a=10
D
分析:氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答:根据铬原子守恒得,1mol Cr2O72-完全反应后生成 FeⅡ[FeⅢx?CrⅢ2-x]O4,
FeⅡ[FeⅢx?CrⅢ2-x]O4,
根据铁原子守恒得amol= ①,
①,
该反应中得失电子数相等,1mol×(6-3)= (3-2),3=
(3-2),3= ,解得x=1.5,
,解得x=1.5,
将x=1.5带人①得a=10,
故选D.
点评:本题考查氧化还原反应,根据转移电子数相等及原子守恒来分析解答即可,难度不大.
分析:氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答:根据铬原子守恒得,1mol Cr2O72-完全反应后生成
 FeⅡ[FeⅢx?CrⅢ2-x]O4,
FeⅡ[FeⅢx?CrⅢ2-x]O4,根据铁原子守恒得amol=
 ①,
①,该反应中得失电子数相等,1mol×(6-3)=
 (3-2),3=
(3-2),3= ,解得x=1.5,
,解得x=1.5,将x=1.5带人①得a=10,
故选D.
点评:本题考查氧化还原反应,根据转移电子数相等及原子守恒来分析解答即可,难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目