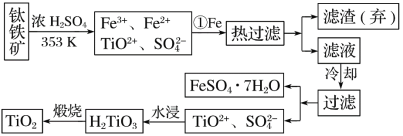
题目内容
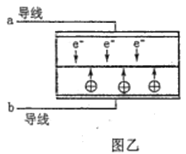
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
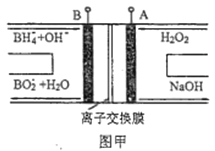
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
【答案】C
【解析】A.电池放电过程中, 负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e= BO2+6H2O,A电极为正极,正极电极反应式为H2O2+2e-=2OH-,为维持电荷平衡,应选用阳离子交换膜,原电池中阳离子移向正极,Na+从负极区向正极区移动,故A正确; B.根据图片知,双氧水得电子发生还原反应,则A电极为正极,正极电极反应式为H2O2+2e-=2OH-,故B正确;C.负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e= BO2+6H2O,有1molNaBH4参加反应转移电子数为:8NA,故C错误;D. 要使LED发光二极管正常发光,图乙中的导线a阴极应与图甲中的B极负极相连,故D正确。答案选C.

【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。