题目内容
11.如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题: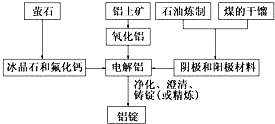
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是Al2O3(填化学式).石油炼制和煤的干馏产品石墨(或碳)(填物质名称)作电解铝的阴极和阳极材料.
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是降低Al2O3的熔点,减少熔融电解质的能耗.
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式Al2O3+4AlF63-═3Al2OF62-+6F-.若电解的总反应为2Al2O3+3C$\frac{\underline{\;电解\;}}{\;}$3CO2+4Al,则阳极的电极反应式为C+2Al2OF62-+12F--4e-═CO2+4AlF63-.
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O.
(5)已知生产1mol铝消耗的电能为1.8×106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=0.033%.(热回收效率=回收能量/生产耗能×100%)
分析 传统的工业生产金属铝的基本流程为:萤石主要成分为氟化钙,萤石中加入冰晶石和氟化钙,降低三氧二化铝熔化时所需的温度,电解氧化铝得到铝和氧气,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝,电解得到的铝净化、澄清铸锭.
(1)工业上用氧化铝冶炼金属铝,据此确定铝土矿的成分;冶炼铝的电解槽中的阴极和阳极材料均为惰性电极;
(2)冰晶石能溶解Al2O3晶体,被用作助熔剂降低Al2O3的熔点;
(3)氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,依据电荷守恒和原子守恒配平书写离子方程式;
(4)冰晶石能在碱性溶液中分解,冰晶石与足量NaOH溶液反应生成两种钠盐分别为偏铝酸钠和氟化钠,结合原则守恒配平书写化学方程式;
(5)生产9g铝制饮料罐消耗的电能=$\frac{9g}{27g/mol}$×1.8×103KJ,热回收效率=$\frac{回收能量}{生产耗能}$×100%.
解答 解:传统的工业生产金属铝的基本流程为:萤石主要成分为氟化钙,萤石中加入冰晶石和氟化钙,降低三氧二化铝熔化时所需的温度,电解氧化铝得到铝和氧气,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝,电解得到的铝净化、澄清铸锭.
(1)工业上用电解熔融氧化铝的方法冶炼铝,冶炼金属铝时用的主要冶炼是铝土矿,说明铝土矿的主要成分是Al2O3,电解法冶炼金属铝需要使用惰性电极,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝;
故答案为:Al2O3;石墨(或碳);
(2)Al2O3属于离子晶体,熔点较高,加入冰晶石和氟化钙,熔融的冰晶石和氟化钙能溶解Al2O3晶体,所以其在电解冶炼铝时被用作助熔剂,降低三氧二化铝熔化时所需的温度,在金属铝的冶炼中加入冰晶石和氟化钙的目的是降低Al2O3的熔点,减少熔融电解质的能耗;
故答案为:降低Al2O3的熔点,减少熔融电解质的能耗;
(3)氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,依据电荷守恒和原子守恒配平书写离子方程式为:Al2O3+4AlF63-═3Al2OF62-+6F-; 若电解的总反应为2Al2O3+3C$\frac{\underline{\;电解\;}}{\;}$3CO2+4Al,电解池中阳极上是元素化合价升高失电子发生氧化反应,则阳极的电极反应式:C+2 Al2OF62-+12F--4e-═CO2+4 AlF63-;
故答案为:Al2O3+4AlF63-═3Al2OF62-+6F-;C+2 Al2OF62-+12F--4e-═CO2+4 AlF63-;
(4)冰晶石与足量NaOH溶液反应生成两种钠盐分别为偏铝酸钠和氟化钠,结合原则守恒配平书写化学方程式为:Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O;
故答案为:Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O;
(5)已知生产1mol铝消耗的电能为1.8×106J,9g铝制饮料罐可回收能量为0.2kJ,生产9g铝制饮料罐消耗的电能=$\frac{9g}{27g/mol}$×1.8×103KJ,则铝制饮料罐的热回收效率η=$\frac{回收能量}{生产耗能}$×100%=$\frac{0.2KJ}{\frac{9}{27}×1.8×1{0}^{6}KJ}$×100%=0.033%,故答案为:0.033%.
点评 本题考查化学工艺流程、电解原理等,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.注意复杂离子方程式和化学方程式的书写方法应用.

 阅读快车系列答案
阅读快车系列答案| A. | 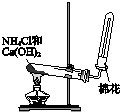 用a制备并收集氨气 | B. | 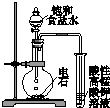 用b制备并检验乙炔 | ||
| C. | 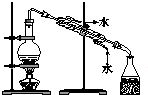 用c蒸馏海水得到淡水 | D. | 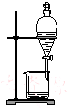 用d分离Na2CO3溶液与CH3COOC2H5 |
| A. | $\frac{11.2X}{5A}$mol-1 | B. | $\frac{5A}{11.2X}$mol-1 | C. | $\frac{22.4A}{5X}$mol-1 | D. | $\frac{22.4X}{5A}$mol-1 |
| 选项 | 实验 | 现象 | 结论 |
| A | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有强氧化性 |
| B | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有较多水 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向AgCl悬浊液中滴加KI溶液 | 白色沉淀变黄色 | AgI的溶解度大于AgCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
①羟基的电子式:[
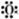 H]-
H]-②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:${\;}_{8}^{16}$O
⑤铝离子的结构示意图:
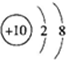
⑥二氧化碳分子的比例模型:

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
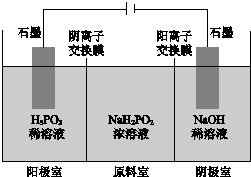 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |