题目内容
下列反应属于吸热反应的是
| A.葡萄糖在人体内氧化分解 | B.氢气在氧气中燃烧 |
| C.氢氧化钡晶体与氯化铵晶体反应 | D.氢氧化钾和硫酸中和 |
C
解析试题分析:如果反应物的总能量高于生成物的总能量,反应就是放热反应,反之是吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,据此可知选项A、B、D均是放热反应,C是吸热反应,答案选C。
考点:考查放热反应与吸热反应的判断

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
化学反应中通常伴随着能量变化,下列说法中错误的是
| A.煤燃烧时将部分化学能转化为热能 |
| B.电解熔融Al2O3时将部分化学能转化为电能 |
| C.TNT爆炸时将部分化学能转化为动能 |
| D.镁条燃烧时将部分化学能转化为光能 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
已知下列四个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H1; 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2;
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H3; 2H2S(g)+O2(g)=2S(s)+2H2O(l) △H4;
则△H四者的关系中正确的是
| A.△H1>△H2>△H3>△H4 | B.△H4>△H2>△H3>△H1 |
| C.△H3>△H4>△H1>△H2 | D.△H4>△H3>△H2>△H1 |
已知:
| A.-393.5kJ/mol | B.-679.3 kJ/mol | C.-787 k J/mol | D.+180.9 kJ/mol |
下列化学变化中,反应物的总能量低于生成物的总能量的是( )
A.2H2 +O2 2H2O 2H2O | B.CaO + H2O= Ca(OH)2 |
C.CaCO3 CaO + CO2↑ CaO + CO2↑ | D.CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O 2CO2 + 3 H2O |
下列说法正确的是( )
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |
半导体工业用石英砂做原料通过三个重要反应生产单质硅
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
| A.21.44kJ | B.600.20kJ | C.21435.71kJ | D.1965.10kJ |
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如下图所示,E1表示反应A+B→X的活化能。 下列有关叙述正确的是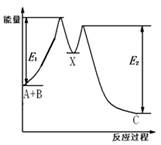
| A.E2表示反应X→C的活化能 |
| B.反应A+B→C的△H<0 |
| C.X是反应A+B→C的催化剂 |
| D.加入催化剂可改变反应A+B→C的焓变 |