��Ŀ����
����Ŀ��ij��ҵ��ˮ�к���CN-��Cr2O72��������,�辭��ˮ������������ŷ�,��ˮ�����������������̽��д���:
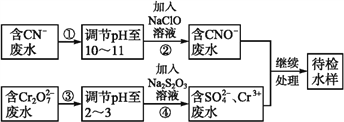
�ش���������:
��1���������,CN-��ClO-����ΪCNO-�����ӷ���ʽΪ_______________��
��2������ܵķ�ӦΪS2+Cr2O72��+H+![]() SO42-+Cr3++H2O(δ��ƽ), ��ÿ����0.4 molCr2O72��ת��ת��____mol e-��
SO42-+Cr3++H2O(δ��ƽ), ��ÿ����0.4 molCr2O72��ת��ת��____mol e-��
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ������,Ŀ����_________________��
��4����25 ����,��a mol��L-1��NaCN��Һ��0.01 mol��L-1�������������,��Ӧ������ҺpH=7,�ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka=____����25 ��ʱ��Ũ�Ⱦ�Ϊ0.1 mol��L-1��NaCN��HCN��Һ�������Ϻ�,��Һ�ʼ���,����ڸ���Һ��˵������ȷ����____(����ĸ)��
a.����Һһ����c(Na+)+c(H+)=c(OH-)+c(CN-)
b.����Һһ����c(Na+)=c(HCN)+c(CN-)
c.�����Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶�
d.����Һ���������������ƻ�����,��Һ��pH�仯����
��5����ȥ��ˮ�е�������:ȡˮ�����Թ���,����NaOH��Һ�۲쵽����ɫ��������,�����������ٲ�����ɫ����Ϊֹ,������Һ�м���һ������Na2S��Һ,��ɫ����ת���ɺ�ɫ�������ù����з�Ӧ�����ӷ���ʽΪ_______��___________��
���𰸡� CN-+ClO-![]() CNO-+Cl- 2.4 ���ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) (100a-1)��10-7 mol��L-1 b Cu2++2OH-
CNO-+Cl- 2.4 ���ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) (100a-1)��10-7 mol��L-1 b Cu2++2OH-![]() Cu(OH)2�� Cu (OH)2(s)+S2-(aq)
Cu(OH)2�� Cu (OH)2(s)+S2-(aq)![]() CuS(s)+2OH-(aq)
CuS(s)+2OH-(aq)
����������1��������������������£�CN��������NaClO����������ԭ��Ӧ����CNO����Cl�����ӣ����ӷ�ӦΪ��CN��+ClO���TCNO��+Cl������2������ܵķ�ӦΪS2+Cr2O72��+H+![]() SO42-+Cr3++H2O(δ��ƽ)������0.4 mol Cr2O72����ת��ΪCr3������Ԫ�ػ��ϼ۽���3�ۣ�0.4molCr2O72�����õ���0.4����2��3��mol=2.4mol����3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) ����4���ɵ���غ�c��Na����+c��H����=c��OH����+c��CN����+c��Cl������pH=7����֪c��H����=c��OH����=10-7 mol��L��1��c��CN����=c��Na����-c��Cl����=a/2mol��L��1-0.01/2mol��L��1���ٸ��������غ㣺c��CN����+c��HCN��=c��Na����=a/2mol��L��1��Ka��c(H��)��c(CN��)/c(HCN)=
SO42-+Cr3++H2O(δ��ƽ)������0.4 mol Cr2O72����ת��ΪCr3������Ԫ�ػ��ϼ۽���3�ۣ�0.4molCr2O72�����õ���0.4����2��3��mol=2.4mol����3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) ����4���ɵ���غ�c��Na����+c��H����=c��OH����+c��CN����+c��Cl������pH=7����֪c��H����=c��OH����=10-7 mol��L��1��c��CN����=c��Na����-c��Cl����=a/2mol��L��1-0.01/2mol��L��1���ٸ��������غ㣺c��CN����+c��HCN��=c��Na����=a/2mol��L��1��Ka��c(H��)��c(CN��)/c(HCN)=
 = (100a-1)��10-7 mol��L-1����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ�a���ݵ���غ��֪c��H����+c��Na����=c��CN����+c��OH����������Һһ����c��Na����+c��H����=c��OH����+c��CN��������a��ȷ��b���������غ��֪c��HCN��+c��CN����=0.1mol��L-1������c��HCN��+c��CN����=2c��Na��������b����c����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ������Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶ȣ���c��ȷ��d����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ��γɻ�����Һ������Һ��������������������ˮ�⣬�ٽ����룬�����������Ƶ���ٽ�ˮ�⣬��Һ����Ա仯����������Һ��pH�仯����d��ȷ����ѡb����5����ɫ����ΪCu(OH)2��CuS��s����Cu(OH)2��s�������ܣ������˳�����ת������Ӧ����ʽΪ��Cu2++2OH-
= (100a-1)��10-7 mol��L-1����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ�a���ݵ���غ��֪c��H����+c��Na����=c��CN����+c��OH����������Һһ����c��Na����+c��H����=c��OH����+c��CN��������a��ȷ��b���������غ��֪c��HCN��+c��CN����=0.1mol��L-1������c��HCN��+c��CN����=2c��Na��������b����c����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ������Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶ȣ���c��ȷ��d����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ��γɻ�����Һ������Һ��������������������ˮ�⣬�ٽ����룬�����������Ƶ���ٽ�ˮ�⣬��Һ����Ա仯����������Һ��pH�仯����d��ȷ����ѡb����5����ɫ����ΪCu(OH)2��CuS��s����Cu(OH)2��s�������ܣ������˳�����ת������Ӧ����ʽΪ��Cu2++2OH-![]() Cu(OH)2�� (7). Cu (OH)2(s)+S2-(aq)
Cu(OH)2�� (7). Cu (OH)2(s)+S2-(aq)![]() CuS(s)+2OH-(aq)
CuS(s)+2OH-(aq)