题目内容
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为ω mol/L.若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是( )
| A、4molA+2molB |
| B、3molC+2molD |
| C、1molB+3molC+1molD |
| D、2molA+1molB+3molC+1molD |
考点:等效平衡
专题:
分析:反应2A(g)+B(g)?3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为1.2mol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
解答:
解:A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为2wmol/L,故A错误;
B、开始加入3molC+1molD,将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、2molB所到达的平衡,达到平衡时C的浓度为1.2mol/L,多加的1molD是固体,不会引起平衡的移动,故B正确;
C、1molB+3molC+1molD,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是wmol/L,故C错误;
D、2molA+1molB+3molC+1molD,按方程式的化学计量数转化到左边,可得4molA、2molB与原反应不是等效平衡,达到平衡时C的浓度为2wmol/L,故D错误;
故选:B.
B、开始加入3molC+1molD,将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、2molB所到达的平衡,达到平衡时C的浓度为1.2mol/L,多加的1molD是固体,不会引起平衡的移动,故B正确;
C、1molB+3molC+1molD,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是wmol/L,故C错误;
D、2molA+1molB+3molC+1molD,按方程式的化学计量数转化到左边,可得4molA、2molB与原反应不是等效平衡,达到平衡时C的浓度为2wmol/L,故D错误;
故选:B.
点评:考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.

练习册系列答案
相关题目
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种常见化合物,下列说法错误的是( )
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
下列有关化学用语表示正确的是( )
A、氯离子的结构示意图: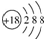 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: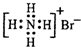 |
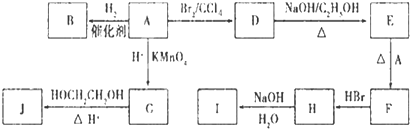
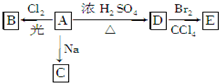 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
