题目内容
14.下些列有关电池的说法错误的是( )| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅酸蓄电池中,铅电极是负极 | |
| C. | 甲醇醇燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,Zn2+沿外电路从正极流向负极 |
分析 A.锂离子电池能充放电,属于二次电池;
B.铅酸蓄电池中,铅作负极、二氧化铅作正极;
C.甲醇燃料电池属于原电池;
D.铜锌原电池中,阳离子从负极移向正极.
解答 解:A.锂离子电池能充放电,属于二次电池,放电时是将化学能转化为电能,充电时是将电能转化为化学能,故A正确;
B.铅酸蓄电池中,铅易失电子发生氧化反应而作负极、二氧化铅得电子发生还原反应而作正极,故B正确;
C.甲醇燃料电池属于原电池,是将化学能转化为电能的装置,故C正确;
D.铜锌原电池中,锌作负极、Cu作正极,Zn2+从负极移向正极,故D错误;
故选D.
点评 本题考查了原电池原理,根据得失电子确定正负极,再结合离子移动方向、原电池概念等知识点分析解答,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
4.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
①b<f②915℃,2.0MPa时E的转化率为60%③该反应的△S<0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
| 压强/MPa G体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
上述①~④中正确的有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
5.下列说法正确的是( )
| A. | 盐桥在电化学中可导通左右半池,其作用和用铜导线连接完全一致 | |
| B. | 室温时,酸碱中和滴定的终点刚好是pH=7的点 | |
| C. | pH计和广泛pH试纸的精确度一致,只是pH计使用更方便 | |
| D. | 向某溶液中滴入2滴黄色的K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中一定含有 Fe2+ |
2.某电化学装置工作原理如图,下列有关说法正确的是( )
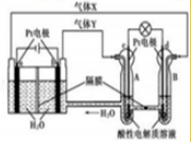

| A. | 气体X为O2 | |
| B. | c电极为负极,发生的电极反应式为H2-2e-=2H+ | |
| C. | 一段时间后A处PH降低 | |
| D. | 当有0.4mol电子转移时,在B极上生成标准状况下气体2.24L |
9.在C2H2、C6H6、C2H2O2组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数( )
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84.9% |
19.下列说法中正确的是( )
| A. | 最外层电子数相同的元素一定属于同一族 | |
| B. | 同周期元素的电子层数相同 | |
| C. | 非金属元素的最外层电子数都≧4 | |
| D. | 元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
6.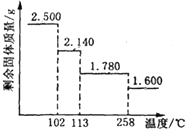 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
3.某温度下,甲溶液的pH是乙溶液的两倍,则甲溶液中H+的浓度与乙溶液中H+的浓度的关系是( )
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |