题目内容
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.该体系中有CaF2沉淀产生
C.该体系中KSP(CaF2)= 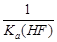 D.KSP(CaF2)随温度和浓度的变化而变化
D.KSP(CaF2)随温度和浓度的变化而变化
【答案】
B
【解析】电离常数Ka(HF)=3.6×10-4 mol·L-1,则0.1
mol·L-1HF溶液中氢离子浓度是6×10-3mol/L,A不正确。1L 0.2
mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液后,氟化氢的变为0.1mol/L,氟离子浓度是6×10-3mol/L,钙离子浓度是0.1mol/L,所以 >KSP(CaF2),所以有沉淀析出,B正确。由于KSP(CaF2)=
>KSP(CaF2),所以有沉淀析出,B正确。由于KSP(CaF2)= ,而Ka(HF)=
,而Ka(HF)= ,所以选项C不正确。溶度积常数只与温度有关系,所以D不正确,答案选B。
,所以选项C不正确。溶度积常数只与温度有关系,所以D不正确,答案选B。

练习册系列答案
相关题目
 (2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
(2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
