题目内容
20.黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2═6SO2+Fe3O4,氧化产物为SO2和Fe3O4,若有3mol FeS2参加反应,转移电子数为32NA.分析 反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
解答 解:反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;
因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol,所以电子转移数为32NA,
故答案为:SO2和Fe3O4;32NA.
点评 本题综合考查氧化还原反应,为高频考点,侧重学生的分析、计算能力的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关金属Na的叙述不正确的是( )
| A. | Na在空气中燃烧生成过氧化钠 | B. | Na 比Mg更容易失电子 | ||
| C. | Na应该保存在酒精里 | D. | Na与水反应时熔成小球,浮在水面 |
11.下列关于油脂的叙述中错误的是( )
| A. | 从溴水中提取溴可用植物油作萃取剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| D. | 用热的碱溶液可区别植物油和矿物油 |
8.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 32g O2、O3混合气体中含有的氧原子数目为2NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molFe与足量Cl2反应时转移的电子数目为2NA | |
| D. | 1mol•L-1MgCl2溶液中含有的氯离子数目为2NA |
15.常温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
9.工业合成氨反应N2(g)+3H2(g)?2NH3(g).设在容积为2L的密闭容器中充入1.0mol氮气和1.6mol氢气,反应在一定条件下达到平衡时,NH3的物质的量为0.8mol.下列叙述正确的是( )
| A. | N2的转化率是60% | B. | 该反应的平衡常数 是12.5 | ||
| C. | 平衡时总物质的量是2.6mol | D. | 平衡时气体的密度是15.6g/L |
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷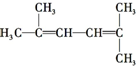
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.