题目内容
在密闭容器中进行如下反应:
2SO2(g)+O2(g)?2SO3(g)△H<0现根据下表所示,回答:
(1)此反应的平衡常数表达式为= ;
(2)表中最大的平衡常数是 ;
(3)当反应在200℃达到平衡时,如增加氧气的量,则平衡 移动(正向、逆向、不),K1值 (增大、减小、不变).
2SO2(g)+O2(g)?2SO3(g)△H<0现根据下表所示,回答:
| 温 度 | 200℃ | 300℃ | 400℃ |
| 平衡常数 | K1 | K2 | K3 |
(2)表中最大的平衡常数是
(3)当反应在200℃达到平衡时,如增加氧气的量,则平衡
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:(1)平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,据此答题;
(2)由于该反应为放热反应,所以升高温度平衡逆向移动,平衡常数减小,据此判断;
(3)增加氧气的量,反应浓度增大,平衡向正反应方向移动,平衡常数只与温度有关,故平衡常数不变.
(2)由于该反应为放热反应,所以升高温度平衡逆向移动,平衡常数减小,据此判断;
(3)增加氧气的量,反应浓度增大,平衡向正反应方向移动,平衡常数只与温度有关,故平衡常数不变.
解答:
解:(1)平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,所以K=
,故答案为:
;
(2)由于该反应为放热反应,所以升高温度平衡逆向移动,平衡常数减小,所以在200℃时平衡常数K1 最大,故答案为:K1;
(3)增加氧气的量,反应浓度增大,平衡向正反应方向移动,平衡常数只与温度有关,故平衡常数不变,故答案为:正向;不变.
| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
(2)由于该反应为放热反应,所以升高温度平衡逆向移动,平衡常数减小,所以在200℃时平衡常数K1 最大,故答案为:K1;
(3)增加氧气的量,反应浓度增大,平衡向正反应方向移动,平衡常数只与温度有关,故平衡常数不变,故答案为:正向;不变.
点评:本题主要考查了化学平衡常数的定义及影响因素,难度不大,注重了基础知识的考查.

练习册系列答案
相关题目
因发生电极反应,直接破坏了该电极附近水的电离平衡的是.( )
| A、用惰性电极电解氯化铜溶液的阴极 |
| B、铜锌(稀硫酸作电解质)原电池的正极 |
| C、用惰性电极电解饱和食盐水的阴极 |
| D、用惰性电极电解饱和硫酸钠溶液的阳极 |
不需要添加任何试剂就能鉴别出来的一组物质是( )
| A、氯化钠、硝酸铵、氯化铁三种固体 |
| B、氢气、甲烷、一氧化碳三种气体、 |
| C、氯化铵、氢氧化钾、硝酸钠三种溶液 |
| D、酒精、汽油、蒸馏水三种液体 |
下列有关实验操作或方案的说法中正确的是( )
| A、分离FeCl3和AlCl3两种物质的混合物,只用氢氧化钠和二氧化碳即可 |
| B、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C、稀硫酸滴定未知浓度的NaHCO3溶液,用甲基橙作指示剂,溶液由黄色变为橙色 |
| D、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |
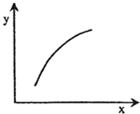 在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)═3C(g)△H<0,达到平衡后,改变一个条件(x),如表量(y)一定符合图中曲线的是( )
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)═3C(g)△H<0,达到平衡后,改变一个条件(x),如表量(y)一定符合图中曲线的是( )