题目内容
 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:途径Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
途径Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2
(1)上述反应符合“原子经济”规律的是
(2)下列各项中,能够说明反应Ⅱ已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CO、H2和CH3OH的浓度保持不变
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
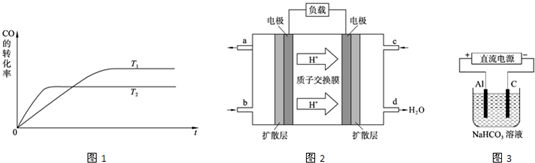
(3)如图是反应途径Ⅱ在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H2_
②如表所列数据是反应途径Ⅱ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 350℃ |
| K | 2.041 | 0.012 |
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1
③H2O(g)=H2O(l)△H=-c kJ?mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
(5)用甲醇作燃料,KOH溶液作电解液,惰性电极材料组成的原电池工作时,其正极反应式
分析:(1)原子经济性主要是指原子利用率高,化合反应原子利用率是100%;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)①对于吸热反应,温度越高,K越大,反之越低,对于放热反应,温度越高,K越小,反之越大;
②根据温度对化学平衡移动的影响来回答判断即可;
(4)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热越乘以相应的系数并进行相应的计算;
(5)根据燃料电池的工作原理规律:正极上是氧气得电子的还原反应,负极上是燃料失电子的氧化反应来回答.
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)①对于吸热反应,温度越高,K越大,反之越低,对于放热反应,温度越高,K越小,反之越大;
②根据温度对化学平衡移动的影响来回答判断即可;
(4)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热越乘以相应的系数并进行相应的计算;
(5)根据燃料电池的工作原理规律:正极上是氧气得电子的还原反应,负极上是燃料失电子的氧化反应来回答.
解答:解:(1)反应Ⅱ属于化合反应,原子利用率是100%,符合“原子经济”规律,故答案为:Ⅱ;
(2)a.该反应是前后气体系数和不相等的反应,当恒温、恒容条件下,容器内的压强不发生变化,证明达到了平衡状态,故a正确;
b.一定条件下,CO、H2和CH3OH的浓度保持不变,是化学平衡状态的特征,故b正确;
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,证明正逆反应速率相等,达到了平衡状态,故c正确;
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH,不能证明正逆反应速率相等,不一定达到了平衡状态,故d错误.
故选abc;
(3)①根据图示的数据可以知道,温度越高,K越小,所以反应是一个放热反应,故答案为:<;
②250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,故答案为:250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,△H2<0;
(4)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1,
③H2O(g)=H2O(l)△H=-c kJ?mol-1,
根据盖斯定律可知,则
可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=
kJ/mol=
kJ/mol,
故答案为:
kJ/mol;
(5)燃料电池的工作原理规律:正极上是氧气得电子的还原反应,在碱性环境下,电极反应式为:O2+2H2O+4e-=4OH-,负极上是燃料失电子的氧化反应,在碱性环境下,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:O2+2H2O+4e-=4OH-;CH3OH-6e-+8OH-=CO32-+6H2O.
(2)a.该反应是前后气体系数和不相等的反应,当恒温、恒容条件下,容器内的压强不发生变化,证明达到了平衡状态,故a正确;
b.一定条件下,CO、H2和CH3OH的浓度保持不变,是化学平衡状态的特征,故b正确;
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,证明正逆反应速率相等,达到了平衡状态,故c正确;
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH,不能证明正逆反应速率相等,不一定达到了平衡状态,故d错误.
故选abc;
(3)①根据图示的数据可以知道,温度越高,K越小,所以反应是一个放热反应,故答案为:<;
②250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,故答案为:250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,△H2<0;
(4)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1,
③H2O(g)=H2O(l)△H=-c kJ?mol-1,
根据盖斯定律可知,则
| ①-②+③×4 |
| 2 |
| (-a)-(-b)+(-c)×4 |
| 2 |
| b-a-4c |
| 2 |
故答案为:
| b-a-4c |
| 2 |
(5)燃料电池的工作原理规律:正极上是氧气得电子的还原反应,在碱性环境下,电极反应式为:O2+2H2O+4e-=4OH-,负极上是燃料失电子的氧化反应,在碱性环境下,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:O2+2H2O+4e-=4OH-;CH3OH-6e-+8OH-=CO32-+6H2O.
点评:本题涉及电化学、热化学以及化学反应速率和平衡的影响因素、判断化学平衡的方法等知识,属于综合知识的考查,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).