题目内容
下列反应离子方程式正确的是( )A.溴化亚铁溶液中通入过量氯气:
Fe2++2Br+2Cl2![]() Fe3++Br2+4Cl-
Fe3++Br2+4Cl-
B.氯气通入冷的氢氧化钠溶液中:
2Cl2+2OH-![]() 3Cl-+ClO-+H2O
3Cl-+ClO-+H2O
C.向澄清石灰水中加入少量小苏打溶液:
Ca2++![]()
![]() CaCO3↓+H2O
CaCO3↓+H2O
D.氨水中通入过量二氧化硫:
2NH3·H2O+SO2![]() 2
2![]() +
+![]() +2H2O
+2H2O
C
解析:A中电荷不守恒,得失电子数不守恒,应为:
2Fe2++4Br-+3Cl2![]() 2Fe3++2Br2+6Cl-。
2Fe3++2Br2+6Cl-。
B中得失电子不守恒,应为:
Cl2+2OH-![]() Cl-+ClO-+H2O。
Cl-+ClO-+H2O。
C中因为![]() 少,应以
少,应以![]() 为主进行离子方程式的书写:1个
为主进行离子方程式的书写:1个![]() 消耗1个OH-生成1个
消耗1个OH-生成1个![]() ,最终得到1个CaCO3↓。
,最终得到1个CaCO3↓。
D中二氧化硫过量,产物应为![]() ,正确书写方式为:
,正确书写方式为:
NH3·H2O+SO2![]()
![]() +
+![]() 。
。

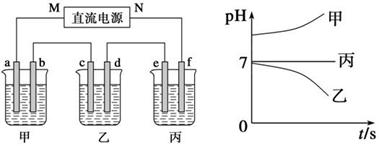
(10分)X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放250 mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)。
(2)甲烧杯中电极b上发生的电极反应为 。
(3)乙烧杯电解的总反应离子方程式为_________________________________,电解一段时间后停止电解(此时溶液中还有原溶质),若要将乙烧杯中的溶液恢复到原状态,则需要加入 (填化学式)。
(4)若经过一段时间后,丙装置中两极附近均滴酚酞, _______极附近变红,其原因是
。
(10分)X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Na+、K+、Cu2+ |
|
阴离子 |
SO42—、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放250 mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极。
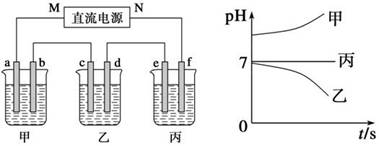
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)。
(2)甲烧杯中电极b上发生的电极反应为 。
(3)乙烧杯电解的总反应离子方程式为_________________________________,电解一段时间后停止电解(此时溶液中还有原溶质),若要将乙烧杯中的溶液恢复到原状态,则需要加入 (填化学式)。
(4)若经过一段时间后,丙装置中两极附近均滴酚酞, _______极附近变红,其原因是
。[来源:学_科_网]