题目内容
【化学—选修3:物质结构与性质】(15分)
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。

(1)1s22s22p63s23p63d9(或[Ar]3d9) (1分);
(2)正四面体(1分);sp3(1分);CCl4或SiCl4 (2分,其他合理答案也得分);
(3) (2分);
(2分);
(4)在相同温度下,Ksp(CuS)<Ksp(ZnS),或相同温度下,CuS 比ZnS更难溶。(2分,其他合理答案也得分);
(5)低(1分),CuO晶格能比CuS大(1分,其他合理答案也得分);
(6) (2分,其他合理答案均得分);
(2分,其他合理答案均得分);
 (2分,其他合理答案均得分)。
(2分,其他合理答案均得分)。
【解析】
试题分析:(1)铜为29号元素,根据构造理论知Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9(或[Ar]3d9);(2)根据价层电子对互斥理论和杂化轨道理论知,SO42-的空间构型为正四面体;中心原子采用的轨道杂化方式是sp3;等电子体是价电子数目和原子数目相同的微粒,与SO42-互为等电子体的分子的化学式:CCl4或SiCl4;(3) [Cu(OH)4]2-的结构示意图见答案;(4)在相同温度下,Ksp(CuS)<Ksp(ZnS),或相同温度下,CuS 比ZnS更难溶,沉淀易向更难溶的方向转化;(5)CuS比CuO的熔点低,原因是CuO晶格能比CuS大;(6)根据ZnS的晶体结构知,1mol晶胞中含有4molZnS,故1mol晶胞的质量为(4×97)g,1mol晶胞的体积为540.0 3pm3×NA,密度为 ,根据立体几何知识知a位置S2-离子与b位置Zn2+离子之间的距离为
,根据立体几何知识知a位置S2-离子与b位置Zn2+离子之间的距离为 。
。
考点:考查物质结构与性质。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
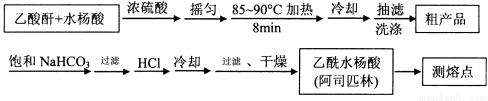
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)  与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: