题目内容
20.物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸溶液反应的溶液中,pH最大的是( )| A. | Na2CO3溶液 | B. | Na[Al(OH)4]溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
分析 能与强酸、强碱反应的物质有Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸的铵盐、氨基酸等,溶液pH最大,说明生成的盐相对应的酸酸性最弱,据此分析解答.
解答 解:能与强酸、强碱反应的物质有Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸的铵盐、氨基酸等,反应中pH最大,说明生成的盐相对应的酸酸性最弱,
碳酸钠和Na[Al(OH)4]都属于弱酸正盐,和NaOH不反应;
碳酸氢钠属于弱酸酸式盐,能和NaOH、HCl反应,碳酸氢根离子水解程度大于电离程度,导致碳酸氢钠溶液呈碱性;
亚硫酸钠属于弱酸酸式盐,能和NaOH、HCl反应,亚硫酸氢根离子水解程度小于电离程度,其溶液呈酸性;
所以既能跟NaOH溶液反应、又能跟盐酸溶液反应的溶液中,pH最大的是碳酸氢钠,故选C.
点评 本题考查两性物质及溶液pH大小判断,明确哪些物质能和强酸、强碱反应是解本题关键,再结合盐类水解分析解答,注意总结归纳元素化合物知识,题目难度不大.

练习册系列答案
相关题目
6.某原电池总反应离子方程式为.2Fe3++Fe?3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |
15.下列说法中,正确的是( )
| A. | 苯酚和苯都能和溴水发生苯环上的取代反应 | |
| B. | 醇属于烃的衍生物,饱和一元醇的组成符合CnH2nO | |
| C. | 乙醇是无色透明的液体,密度比水小,能用乙醇从碘水中萃取出碘 | |
| D. | 向苯酚钠溶液中通入CO2气体,使溶液变浑浊,说明碳酸的酸性比苯酚的强 |
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
12.下列说法正确的是( )
| A. | 燃料电池的能量转化率可达100% | |
| B. | 充电电池可以无限制地反复放电、充电 | |
| C. | 化学能与其他形式的能相互转化的途径是化学反应 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
10.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
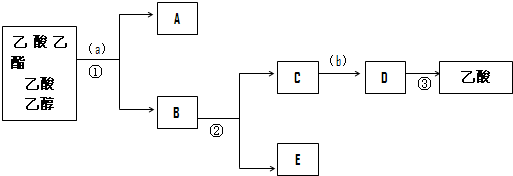
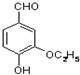 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.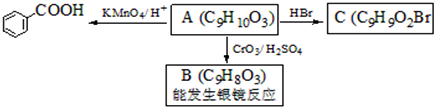
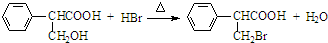 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.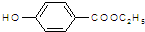 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用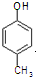 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).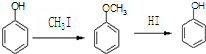

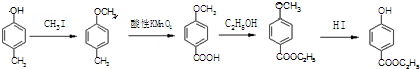
 .
.