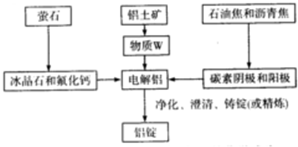
题目内容
17.一包含有NH4NO3和(NH4)2CO3的白色固体样品.配制成1L溶液,然后先取10mL溶液,加入足量的NaOH溶液加热,可收集到0.672L气体(标准状况),再另取10mL溶液加入足量盐酸,也可收集到0.224L气体(标准状况),求:(1)溶液中铵根离子的物质的量浓度?
(2)样品中NH4NO3和(NH4)2CO3的质量?
分析 (1)氢氧化钠足量,则溶液中铵根离子完全转化成氨气,根据氨气的体积计算出10mL溶液中铵根离子物质的量,再计算出1L铵根离子的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中铵根离子的浓度;
(2)盐酸质量,碳酸铵完全转化成二氧化碳,根据C原子守恒计算出碳酸铵的物质的量,再根据铵根离子的物质的量计算出硝酸铵的物质的量,最后根据m=nM计算出样品中NH4NO3和(NH4)2CO3的质量.
解答 解:(1)NH4NO3和(NH4)2CO3的配制的溶液中加入足量氢氧化钠溶液加热,铵根离子完全转化成氨气,根据质量守恒,氨气的物质的量与铵根离子的物质的量相等,则10mL溶液中含有铵根离子的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,1L该溶液中含有铵根离子的物质的量为:0.03mol×$\frac{1000mL}{10mL}$=3mol,该溶液中铵根离子的浓度为:$\frac{3mol}{1L}$=3mol/L,
答:溶液中铵根离子的物质的量浓度为3mol/L;
(2)另取10mL溶液加入足量盐酸,也可收集到0.224L气体(标准状况),该气体为二氧化碳,其物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,根据C原子守恒,1L该溶液中含有碳酸根离子的物质的量为:0.01mol×$\frac{1000mL}{10mL}$=1mol,即碳酸铵的物质的量为1mol,质量为:96g/mol×1mol=96g,
1mol碳酸铵中含有2mol铵根离子,则硝酸铵的物质的量为:3mol-2mol=1mol,1mol硝酸铵的质量为:80g/mol×1mol=80g,
答:样品中NH4NO3和(NH4)2CO3的质量分别为80g、96g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. |  浓硫酸的稀释 | B. |  实验室制取CO2 | C. |  当心火灾 | D. |  禁止吸烟 |
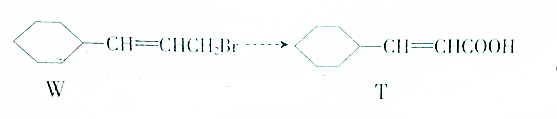
依次发生的有机反应所需要的试剂与条件从左至右依次为( )
①氯化氢,催化剂 ②氢氧化钠水溶液,加热
③氧气,催化剂 ④氢氧化钠醇溶液,加热,酸化.
| A. | ①③②④ | B. | ③①④② | C. | ②①③④ | D. | ①②③④ |
| A. | 硼的原子半径大于铍的原子半径 | |
| B. | 氯化铍分子中铍原子的最外层电子数是8 | |
| C. | 氢氧化铍的碱性比氢氧化钙弱 | |
| D. | 单质铍跟冷水反应产生氢气 |
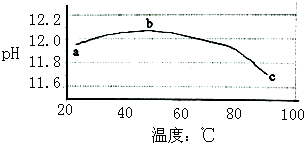 某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )| A. | 碳酸钠水解是吸热反应 | B. | ab段说明水解平衡向右移动 | ||
| C. | bc段说明水解平衡向左移动 | D. | 水的电离平衡也对pH产生影响 |
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 硫化钠溶液呈碱性的原因:S2-+2H2O=H2S+2OH- | |
| C. | 向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ | |
| D. | 氧化亚铁溶于稀硝酸中:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
| A. | 1molNa2O2与水完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| D. | 标准状况时,1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
| A. | 用酒精可以提取某些花香中的酯类香精,制成香水 | |
| B. | 炒菜时加一些料酒和食醋,使菜更香 | |
| C. | 用热水洗涤碗筷去油腻比冷水效果好 | |
| D. | 各种水果有不同的香味,是因为含有不同的酯 |