题目内容
【题目】某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
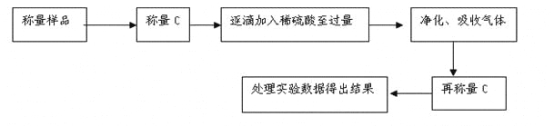
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
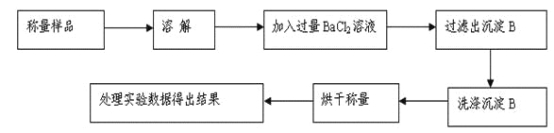
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为_____________。
(2)洗涤沉淀B的操作是___________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
按如下左图所示装置进行实验:
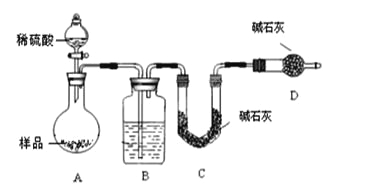
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
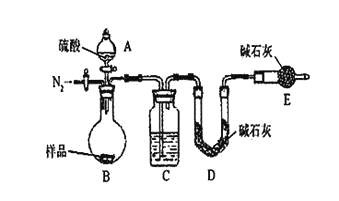
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
【答案】烧杯 用玻璃棒引流,向漏斗中的沉淀注入蒸馏水,直至刚好没过沉淀,待水从漏斗自然流完后,重复上述操作2-3次 ![]() ×100% 浓硫酸 不能 越小 吸收倒入的空气中的水蒸气和二氧化碳,以确保C质量增加量的准确性 将B、C装置中残留CO2全部驱入D装置的碱石灰中,减小实验误差
×100% 浓硫酸 不能 越小 吸收倒入的空气中的水蒸气和二氧化碳,以确保C质量增加量的准确性 将B、C装置中残留CO2全部驱入D装置的碱石灰中,减小实验误差
【解析】
甲组同学用沉淀分析法,将样品溶解,加入过量氯化钡溶液,碳酸钠和氯化钡生成碳酸钡沉淀,将沉淀过滤出来后称量,用碳酸钡的质量计算碳酸钠的质量分数。
乙组同学是利用样品和稀硫酸反应,生成的二氧化碳干燥后用碱石灰吸收,通过测定碱石灰增重的质量计算样品中碳酸钠的质量分数。
(1)过滤操作中除了漏斗、玻璃棒外还需要烧杯;
(2)洗涤沉淀的操作是用玻璃棒引流,向漏斗中的沉淀注入蒸馏水,直至刚好没过沉淀,待水从漏斗自然流完后,重复上述操作2-3次。
(3)加入氯化钡溶液得到的沉淀是碳酸钡沉淀,所以ng碳酸钡的物质的量是![]() mol,则碳酸钠的质量是
mol,则碳酸钠的质量是![]() mol×106g/mol,所以碳酸钠的质量分数是
mol×106g/mol,所以碳酸钠的质量分数是![]() ×100%;
×100%;
(4)方案II是用产生的二氧化碳的质量计算碳酸钠的质量分数,所以装置B中盛放的浓硫酸,起干燥作用;分液漏斗中不能将硫酸改为盐酸,因为盐酸易挥发,挥发的氯化氢被碱石灰吸收,是结果偏高,所以不能换成盐酸;
(5)①等质量的碳酸钠和碳酸氢钠与稀硫酸反应相比,碳酸氢钠放出的二氧化碳多,所以碳酸钠的质量分数越多放出的二氧化碳越少,则干燥管C在充分吸收气体前后的质量差越小;
②装置D的作用是防止外界空气中的二氧化碳、水进入C装置,确保C装置质量增加的准确性;
(6)反应前通入氮气目的是排除装置中的空气,反应后通入氮气是将B、C装置中残留CO2全部驱入D装置的碱石灰中,减小实验误差。

【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400