题目内容
5.二氯化二硫(S2Cl2)可作硫化剂、氯化剂.常温下是一种黄红色液体,沸点137°C,在空气中剧烈水解而发烟.S2Cl2可通过硫与少量氯气在110~140°C反应制得,氯气过量则会生成 SCl2.
(1)选用以下装置制取少量 S2Cl2(加热及夹持装置略):
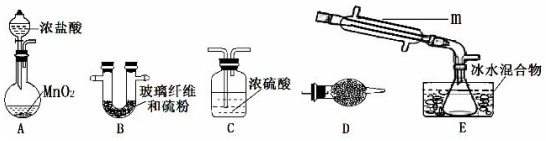
①仪器m 的名称为 冷凝管.
②装置连接顺序:A→C→B→E→D.
③A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
④B中玻璃纤维的作用是增大硫与氯气的接触面积,加快反应.
⑤D中的最佳试剂是a(选填序号).
a.碱石灰 b.浓硫酸 c.NaOH 溶液 d.无水氯化钙
(2)S2Cl2 遇水剧烈水解,生成SO2、HCl 和一种常见的固体.
①该固体是S.
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案不可行(填“是”或“不”),原因是二氧化硫易被硝酸氧化生成硫酸根离子,即难于检验二氧化硫又干扰HCl的检验.
(3)乙同学按如下实验方案检验S2Cl2 是否含有杂质:
①取1.25g 产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3 溶液,过滤、洗涤、干燥,称得固体质量为2.87g.
则产品中氯元素的质量分数为56.8%,由此可知产品中含有(填“含有”或“不含有”)SCl2杂质.
分析 (1)制取少量 S2Cl2:装置A制备氯气,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,C除去氯气中混有水蒸气,B氯气与硫单质的反应,E冷凝收集产物,D吸收空气中的水蒸气和未反应完的氯气,据此分析作答;
(2)①S2Cl2 遇水剧烈水解,生成SO2、HCl 和一种常见的固体,硫元素化合价升高,根据氧化还原反应中化合价有升有降,则该固体为硫元素降价生成的S单质;
②二氧化硫被氧化为硫酸根,不易检验;
(3)S2Cl2中氯元素的质量分数为:$\frac{71}{135}×100%$=52.59%,SCl2中氯元素的质量分数为$\frac{71}{103}×100%$=68.93%,样品中的氯元素质量由AgCl固体计算,与之比较即可.
解答 解:(1)①仪器m为冷凝管,故答案为:冷凝管;
②装置A制备氯气,C除去氯气中混有水蒸气,B氯气与硫单质的反应,E冷凝收集产物,D吸收空气中的水蒸气和未反应完的氯气;
故答案为:C;B;E;D;
③A为二氧化锰与浓盐酸共热制备氯气,发生的反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
④B中为氯气与硫单质的反应,玻璃纤维可以增大硫与氯气的接触面积,加快反应;
故答案为:增大硫与氯气的接触面积,加快反应;
⑤D吸收空气中的水蒸气和未反应完的氯气,选用碱石灰为碱,故答案为:a;
(2)①S2Cl2 遇水剧烈水解,生成SO2、HCl 和一种常见的固体,硫元素化合价升高,根据氧化还原反应中化合价有升有降,则该固体为硫元素降价生成的S单质;
故答案为:S;
②二氧化硫易被硝酸氧化生成硫酸根离子,即难于检验二氧化硫又干扰HCl的检验,该方法不可行;
故答案为:不;二氧化硫易被硝酸氧化生成硫酸根离子,即难于检验二氧化硫又干扰HCl的检验;
(3)所得固体为AgCl,则氯元素的质量为:$\frac{35.5}{143.5}×2.87g$=0.71g,则样品中氯元素的质量分数为$\frac{0.71g}{1.25g}×100%$=56.8%,
又S2Cl2中氯元素的质量分数为:$\frac{71}{135}×100%$=52.59%,SCl2中氯元素的质量分数为$\frac{71}{103}×100%$=68.93%,
52.59%<56.8%<68.93%,故含有SCl2杂质;
故答案为:56.8%;含有.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、数据处理能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

| A. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,lmol H2所占体积约为22.4L,lmol H2和N2混合气体的体积也约为22.4L | |
| C. | 0.1L0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA | |
| D. | 2.3gNa在足量O2中燃烧,转移的电子数为0.2NA |
| 金属或非金属 | 钠 | 铝 | 铁 | 硅 | 硫 |
| 熔点/℃ | 97.8 | 660.4 | 1535 | 1410 | 112.8 |
| 沸点/℃ | 883 | 2467 | 2750 | 2353 | 444.6 |
| A. | 铝与硅 | B. | 铝与硫 | C. | 钠与硫 | D. | 钠与硅 |
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
 (1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)
(1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同) 述中,正确的是( )
述中,正确的是( ) 正确的是( )
正确的是( ) 和水
和水