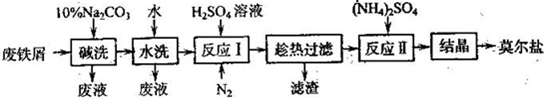
��Ŀ����
�Է���мΪԭ������Ī���ε���Ҫ��������

(1)����ӦI����ͨ��N2��������____________��
(2)��ȡ23. 52 g����Ī���Σ�����ˮ���Ƴ�100 mL��Һ����������Һ�ֳ����ȷݡ�
һ�ݼ�������Ba(OH)2��Һ�����ȣ��ݳ���ʹʪ��ĺ�ɫʯ����ֽ���������壬ͬʱ���ɰ�ɫ�������漴������Ϊ����ɫ�������к��ɫ��������ϡ���ᴦ���������ַ�Ӧ����ˡ�ϴ�Ӻ���ð�ɫ����13. 98 g��
��һ���� 0. 200 0 mol/LK2Cr2O7������Һ�ζ�����CrO72-ǡ����ȫ����ԭΪCr3+ʱ������K2Cr2O7��Һ�����Ϊ25. 00 mL��ͨ������ȷ��Ī���εĻ�ѧʽ��
(3)������ˮϴ����һ��ȥ���������ò�Ʒ�е�SO42-������������____________���� ��ƫ��ƫС�����䡱����
(2)��ȡ23. 52 g����Ī���Σ�����ˮ���Ƴ�100 mL��Һ����������Һ�ֳ����ȷݡ�
һ�ݼ�������Ba(OH)2��Һ�����ȣ��ݳ���ʹʪ��ĺ�ɫʯ����ֽ���������壬ͬʱ���ɰ�ɫ�������漴������Ϊ����ɫ�������к��ɫ��������ϡ���ᴦ���������ַ�Ӧ����ˡ�ϴ�Ӻ���ð�ɫ����13. 98 g��
��һ���� 0. 200 0 mol/LK2Cr2O7������Һ�ζ�����CrO72-ǡ����ȫ����ԭΪCr3+ʱ������K2Cr2O7��Һ�����Ϊ25. 00 mL��ͨ������ȷ��Ī���εĻ�ѧʽ��
(3)������ˮϴ����һ��ȥ���������ò�Ʒ�е�SO42-������������____________���� ��ƫ��ƫС�����䡱����
(1)��ֹFe2+������ΪFe3+������������ã��Լӿ췴Ӧ����
(2)



n(Fe2+)=0. 005 mol��6=0. 03 mol
n(NH4+)+2n(Fe2+)=2n(SO42-)��n(NH4+)=0. 06 mol
n(NH4+)+2n(Fe2+)=2n(SO42-)��n(NH4+)=0. 06 mol
n(H2O)= =0.18 mol
=0.18 mol
 =0.18 mol
=0.18 moln(SO42-)��n(Fe2+)��n(NH4+)��n(H2O)= 0.06 mol��0.03 mol��0. 06 mol��0.18 mol=2��1��2��6
����εĻ�ѧʽΪ(NH4)2Fe(SO4)2��6H2O [��(NH4)2SO4��FeSO4��6H2O]
(3)ƫС
����εĻ�ѧʽΪ(NH4)2Fe(SO4)2��6H2O [��(NH4)2SO4��FeSO4��6H2O]
(3)ƫС

��ϰ��ϵ�д�
�����Ŀ