题目内容
某学生查阅资料发现:①HClO的氧化性强于MnO2;②浓硫酸和氯化钠晶体混合加热可以得到硫酸钠和氯化氢气体。下列四组在实验室制氯气,既符合实际且Cl原子的利用率最高的是:
A.CaCl2和次氯酸
B.浓盐酸和次氯酸钠
C.浓盐酸和次氯酸
D.固体氯化钠,固体次氯酸钠和浓硫酸
【解析】A无法制氯气;B中Na+要结合Cl-;C中浓盐酸要挥发;D中Na+结合SO42-,氯原子全部归到Cl2中,利用率最高。
【答案】D

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目


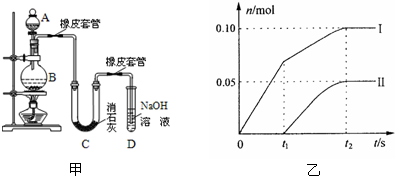
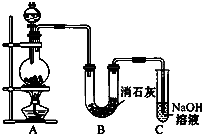 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题: