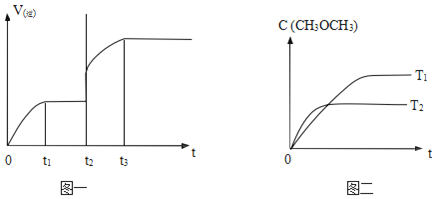
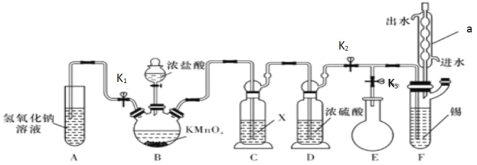
题目内容
【题目】设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1molL-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
【答案】D
【解析】
A.80g SO3的物质的量为![]() =1mol,所含原子数为4NA,故A不符合题意;
=1mol,所含原子数为4NA,故A不符合题意;
B.过氧化钠与水反应时,2Na2O2+2H2O=4NaOH+O2↑,氧元素化合价从-1价变化为-2价和0价,每生成0.1molO2 转移的电子数0.2mol,转移电子数为0.2NA,故B不符合题意;
C.1mol N2、3mol H2 混合反应,氮元素化合价从0价降低为-3价,当生成 0.1molNH3 时,转移电子数目为 0.3NA,故C不符合题意;
D.100mL 0.1molL-1 的 Na2S溶液中含0.01mol Na2S,S2-水解生成HS-、OH-,故阴离子数大于0.01NA,故D符合题意;
故答案为:D。

 阅读快车系列答案
阅读快车系列答案【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用