题目内容
有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子.
(1)依次写出甲、丙种元素的元素符号
(2)甲元素的原子结构示意图为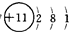
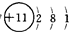 ;乙和丙形成的化合物的化学键类型属于
;乙和丙形成的化合物的化学键类型属于
(3)写出甲、乙、丙三种元素组成的化合物的电子式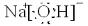
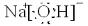 .
.
(1)依次写出甲、丙种元素的元素符号
Na;H
Na;H
;(2)甲元素的原子结构示意图为
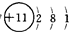
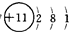
共价键
共价键
.(填“离子键”或者“共价键”)(3)写出甲、乙、丙三种元素组成的化合物的电子式
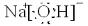
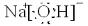
分析:根据甲元素M层的电子数是其K层的电子数的
,所以甲为Na,根据乙元素原子核内无中子,所以乙为H;根据丙元素原子核内有8个质子,所以丙为O.然后根据问题回答.
| 1 |
| 2 |
解答:解:甲元素M层的电子数是其K层的电子数的
,所以甲为Na,根据乙元素原子核内无中子,所以乙为H;根据丙元素原子核内有8个质子,所以丙为O
(1)因甲为Na,乙为H,故答案为:Na;H;
(2)因甲为Na,所以钠的原子结构示意图为: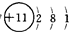 ;因乙和丙形成的化合物为 H2O或H2O2,无论是 H2O还是H2O2 都是由共价键形成的化合物,故答案为:
;因乙和丙形成的化合物为 H2O或H2O2,无论是 H2O还是H2O2 都是由共价键形成的化合物,故答案为: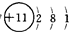 ;共价键.
;共价键.
(3)甲、乙、丙形成的化合物是NaOH,其电子式为: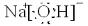 ,故答案为:
,故答案为: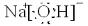 .
.
| 1 |
| 2 |
(1)因甲为Na,乙为H,故答案为:Na;H;
(2)因甲为Na,所以钠的原子结构示意图为:
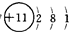 ;因乙和丙形成的化合物为 H2O或H2O2,无论是 H2O还是H2O2 都是由共价键形成的化合物,故答案为:
;因乙和丙形成的化合物为 H2O或H2O2,无论是 H2O还是H2O2 都是由共价键形成的化合物,故答案为: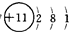 ;共价键.
;共价键.(3)甲、乙、丙形成的化合物是NaOH,其电子式为:
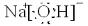 ,故答案为:
,故答案为: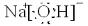 .
.点评:本题考查原子核外电子排布,电子式、化学键,题目难度中等,注意正确推断元素的种类为解答该题的关键.

练习册系列答案
相关题目

