题目内容
16.100mL 6mol•L-1 H2SO4与过量的铁粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )| A. | NaHCO3溶液 | B. | KNO3溶液 | C. | 稀醋酸 | D. | Na2SO4溶液 |
分析 为了减缓反应进行的速率,可降低氢离子浓度或降低温度,但又不影响生成氢气的总量,则氢离子的总物质的量不变,以此解答该题.
解答 解:A.加入碳氢酸钠,消耗硫酸,浓度降低,反应速率减小,且生成氢气的总量减小,故A错误;
B.加入硝酸钾,生成NO气体,影响生成氢气的总量,故B错误;
C.加入醋酸氢离子物质的量增大,生成氢气增多,故C错误;
D.加入硫酸钾溶液,氢离子浓度降低,则反应速率减小,但生成氢气的总量不变,故D正确;
故选D.
点评 本题考查化学反应速率的影响因素,侧重于基础知识的考查,注意把握影响化学反应速率的因素,把握题目要求,为解答该题的关键,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.将足量CO2通入下列溶液中,一定能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 氯化钡溶液 | D. | 氯化钙溶液 |
7.如图为元素周期表截取的短周期的一部分,即 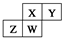 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都属于离子型碳化物.请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
| A. | ZnC2水解生成乙烷 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙炔 | D. | Li2C2水解生成乙烯 |
8.如果把Cu、Zn与稀H2SO4构成的原电池表示为Zn$\stackrel{H_{2}SO_{4}}{→}$Cu,则下列能表示原电池的是( )
| A. | Cu$\stackrel{H_{2}SO_{4}}{→}$Cu | B. | Cu$\stackrel{CuSO_{4}}{→}$Ag | C. | Zn$\stackrel{NH_{4}Cl}{→}$C | D. | Zn$\stackrel{C_{2}H_{5}OH}{→}$Cu |