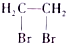题目内容
11.(1)已知反应:2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O,该反应中H2O2只发生如下变化过程中:H2O2→O2①该反应中的还原剂是H2O2,氧化产物是O2(填化学式).
②该反应中,发生还原反应的过程是H2CrO4→Cr(OH)3(填化学式).
(2)漂白粉是常用的消毒剂.
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
②漂白粉的有效成分是(填化学式)Ca(ClO)2.
③若2mol氯气与足量的石灰乳完全反应,则发生转移的电子为2mol.
分析 (1)①H2O2只发生如下变化过程:H2O2→O2,O元素的化合价升高,则H2O2为还原剂被氧化为氧气,而Cr元素的化合价降低,得到电子被还原,对应的产物Cr(OH)3为还原产物;
②Cr元素的化合价降低,发生还原反应;
(2)①根据氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和H2O书写;
②次氯酸钙可生成具有氧化性的HClO,可用于杀菌消毒;
③利用元素的化合价来分析转移的电子数.
解答 解:(1)①反应中O元素的化合价升高,则H2O2为还原剂被氧化生成氧化产物氧气,而Cr元素的化合价降低,得到电子被还原,对应的产物Cr(OH)3为还原产物,
故答案为:H2O2;O2;
②Cr元素的化合价降低,发生还原反应,还原过程为H2CrO4→Cr(OH)3,故答案为:H2CrO4→Cr(OH)3;
(2)①氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②漂白粉的主要成分为CaCl2和Ca(ClO)2,其中Ca(ClO)2可生成具有氧化性的HOCl,可用于杀菌消毒,Ca(ClO)2为漂白粉的有效成分,故答案为:Ca(ClO)2;
③该反应2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O中Cl元素的化合价既升高又降低,则氯气既是氧化剂又是还原剂,2molCl2反应转移的电子为2mol,故答案为:2.
点评 本题主要考查氧化还原反应,卤素元素的单质和化合物的性质,为高频考点,把握反应中元素的化合价变化为解答的关键,注意氯气、次氯酸及其盐的性质和用途,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 苍白色火焰 | B. | 淡黄色火焰 | C. | 蓝紫色火焰 | D. | 耀眼白光 |
| 物质 | 结构 | 某些性质 |
| 草酸 | 分子式:H2C2O4•2H2O | 无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH | 熔点:101℃;升华温度:125℃;170℃以上分解 |
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.
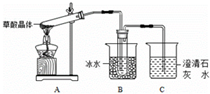
装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有CO2.装置B的主要作用是冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验.装置C中可能发生的反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;H2C2O4+Ca(OH)2=CaC2O4↓+H2O.
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和如图所示的部分装置进行实验.
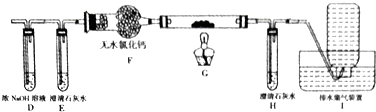
①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是验证二氧化碳是否除完和证明产物中含有一氧化碳;装置G反应管中盛有的固体物质是氧化铜(CuO);I中集气瓶收集到的气体主要是CO.
②能证明草酸晶体分解产物中有CO的现象是H中的粉末由黑色变为红色,D中澄清石灰水变浑浊.
| A. | 原子最外层电子数:X>Y>Z | B. | 离子半径:W3+>Y2- | ||
| C. | 原子序数:X+M>Y+W | D. | 单质沸点:M>Z>Y |
| A. | 化学造成环境污染和严重事故,有媒体打出“我们恨化学”的广告是有道理的 | |
| B. | 易燃物钠、镁着火,若及早发现,消防员可以用高压水枪将其浇灭 | |
| C. | 对危险化工品应贴上相应的危险化学品标志,其中标志上的数字表示危险等级 | |
| D. | 对含剧毒物NaCN的废水,防化部队用H2O2使之氧化,使用双氧水处理现场前,应紧急疏散群众 |
| A. | 陶瓷 | B. | 玻璃 | C. | 水泥 | D. | 玛瑙 |
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
| C | Cl2+2Br?→2Cl?+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+O2 | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
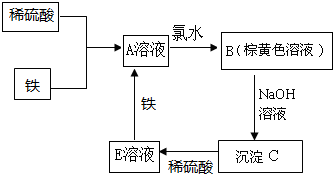 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题: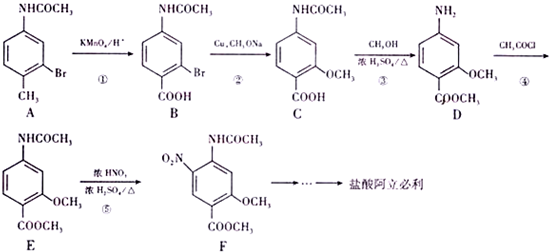
 .
.
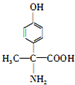
 (该物质易被氧化).请写出以
(该物质易被氧化).请写出以 、CH3COCl、CH3OH为原料制备
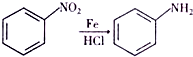
、CH3COCl、CH3OH为原料制备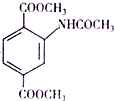 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$