��Ŀ����
����Ŀ��(1)25���£���ˮ��c(H��)��1��10��7 mol��L��1�����ʱc(OH��)��______________�����¶�����ˮ�м����ᣬʹ��Һ�е�c(H��)��1��10��3 mol��L��1�����ʱ��Һ��pH��_______________����25���£���ˮ�м���NaOH���壬ʹ��Һ��pH��13����ʱ��Һ��c(OH��)��___________�� �봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3 ![]() NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
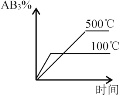
(2)ͬ���������ת���ķ�Ӧ���൱�ٶ�ת������������ʱ���ܲ���ȫ���ⶨʱ�� ���ѣ��ֿ����ݸ�˹���ɽ��м��㡣��֪��
P4 (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H1 ����283.2 kJ��mol��1 ��
4P (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H2 ����184.0kJ��mol��1 ��
���Ȼ�ѧ����ʽ���������ȶ�����ͬ���������� ______(��������������������) ����д������ת���ɺ����Ȼ�ѧ����ʽ______________________________________��
���𰸡�1��10��7 mol��L��1 3 1��10��1mol��L��1��0.1mol��L��1 K = ���� P4 (���ף�s)��4P (���ף�s) ��H1 ����99.2 kJ��mol��1
���� P4 (���ף�s)��4P (���ף�s) ��H1 ����99.2 kJ��mol��1
��������
(1)25���£���ˮ��c(H��)��1��10��7 mol��L��1�����ʱc(OH��)��c(H��)��1��10��7 mol��L��1;
���¶�����ˮ�м����ᣬʹ��Һ�е�c(H��)��1��10��3 mol��L��1�����ʱ��Һ��pH��-lgc(H��)��=-lg10��3=3��
��25���£���ˮ�м���NaOH���壬ʹ��Һ��pH��13����ʱ��Һ��c(OH��)��![]() 0.1mol��L��1��
0.1mol��L��1��
�봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3 ![]() NH4+��NH2�������ݵ���ƽ�ⳣ���Ķ��壬Һ���ĵ���ƽ�ⳣ������ʽK =
NH4+��NH2�������ݵ���ƽ�ⳣ���Ķ��壬Һ���ĵ���ƽ�ⳣ������ʽK = ��
��
(2)���ݸ�˹���ɽ��м��㡣��֪��
P4 (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H1 ����283.2 kJ��mol��1 ��
4P (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H2 ����184.0kJ��mol��1 ��
��-�ڵã�P4 (���ף�s)=4P (���ף�s)��H=��283.2 kJ��mol��1 +184.0kJ��mol��1=-99.2kJ��mol��1�����Ȼ�ѧ����ʽ���������ȶ�����ͬ���������Ǻ��ס�

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�