题目内容
【题目】据![]() 科技日报
科技日报![]() 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________(填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________;
②CH4和HCHO比较,键角较大的是_________,该分子的空间构型为____________。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号![]() 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”![]() ,理由是____________。
,理由是____________。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。
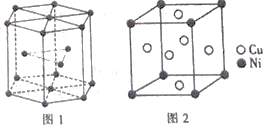
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dgcm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________pm(列出计算式)。
【答案】3d104s1 Zn 光谱分析 HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力 HCHO 平面三角形 < 二者配体相同,但是前者中心离子所带正电荷比后者少,其对电子的吸引力小 六方最密堆积 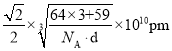
【解析】
⑴具有全充满、半充满、全空的电子构型的原子更稳定,先写出Mn、Fe、Co、Ni、Cu的外围电子排布式,得出结论。
⑵在第四周期过渡金属中,从左到右,第一电离能逐渐增大。
⑶用原子光谱上的特征谱线来鉴定元素称为光谱分析。
⑷①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强;②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大。
⑸Δ[Co(H2O)6]2+带2个单位正电荷,而Δ[Co(H2O)6]3+带3个单位正电荷,后者对电离吸引力更大。
⑹①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距![]() 直角边长度的
直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,再求铜、镍数目,求出棱长,再求两个面心上铜原子最短核间距。
,再求铜、镍数目,求出棱长,再求两个面心上铜原子最短核间距。
⑴具有全充满、半充满、全空的电子构型的原子更稳定,在Mn、Fe、Co、Ni、Cu的外围电子排布式分别为3d54s2、3d64s2、3d74s2、3d84s2、3d104s1,Cu原子核外电子排布遵循“洪特规则特例”;故答案为:3d104s1。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是Zn;故答案为:Zn。
⑶用原子光谱上的特征谱线来鉴定元素称为光谱分析;故答案为:光谱分析。
⑷①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强,故沸点HCOOH > CH3OH > HCHO;故答案为:HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力。
②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大;故答案为:HCHO;平面三角形。
⑸Δ[Co(H2O)6]2+带2个单位正电荷,而Δ[Co(H2O)6]3+带3个单位正电荷,后者对电离吸引力更大,故分裂能Δ[Co(H2O)6]2+ < Δ[Co(H2O)6]3+;故答案为:<;二者配体相同,但是前者中心离子所带正电荷比后者少,其对电子的吸引力小。
⑹①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;故答案为:六方最密堆积。
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距![]() 直角边长度的
直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() 。晶胞中Cu =
。晶胞中Cu = ![]() 、Ni原子数目=
、Ni原子数目= ![]() ,晶胞质量=
,晶胞质量=![]() ,设晶胞棱长为a pm,则:
,设晶胞棱长为a pm,则:![]() ,解得
,解得 ,故两个面心上铜原子最短核间距=
,故两个面心上铜原子最短核间距=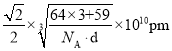 ;故答案为:
;故答案为: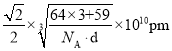 。
。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L