题目内容
3.下列各组顺序的排列正确的是( )| A. | 热稳定性:HCl>H2S>PH3 | B. | 原子半径:Na<Mg<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 碱性强弱:LiOH>NaOH>KOH |
分析 A、元素的非金属性越强,对应的氢化物越稳定;
B、原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、元素的金属性越强,对应的氧化物的水化物的碱性越强.
解答 解:A、非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故A正确;
B、原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小,故B错误;
C、非金属性S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D、金属性K>Na>Li,元素的金属性越强,对应的氧化物的水化物的碱性越强,故D错误;
故选AC.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
11.下列有关有机物的叙述正确的是( )
| A. | 由乙烯与氧气在Ag作催化剂下反应制取环氧乙烷原子利用率可达100% | |
| B. | 高聚物的相对分子质量一定为单体相对分子质量的整数倍 | |
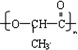
| C. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| D. |  分子中至少有14个原子共平面 分子中至少有14个原子共平面 |
15.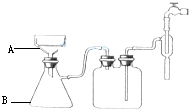 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:
(1)把上述各步骤中的内容补充完整:a:NaCl b:KNO3
(2)写出步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体,步骤⑥的操作名称重结晶,步骤⑦中产生白色沉淀的离子方程式Ag++Cl-═AgCl↓
(3)步骤⑥的抽滤装置如图所示,仪器A的名称布氏漏斗,该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口; 抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
(2)写出步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体,步骤⑥的操作名称重结晶,步骤⑦中产生白色沉淀的离子方程式Ag++Cl-═AgCl↓
(3)步骤⑥的抽滤装置如图所示,仪器A的名称布氏漏斗,该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口; 抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
12.已知1mol白磷(s)转化为1mol红磷(s),放出18.39kJ热量,又知:
4P(白,s)+5O2(g)═2P2O5(s);△H1
4P(红,s)+5O2(g)═2P2O5(s);△H2
△H1△H2关系正确的是( )
4P(白,s)+5O2(g)═2P2O5(s);△H1
4P(红,s)+5O2(g)═2P2O5(s);△H2
△H1△H2关系正确的是( )
| A. | △H1<△H2 | B. | △H1=△H2 | C. | △H1>△H2 | D. | 无法确定 |
13.以下关于混合物分离提纯操作或原理说法正确的是( )
| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液 | |
| C. | 利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
 ;
;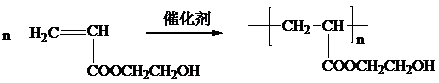 .
.