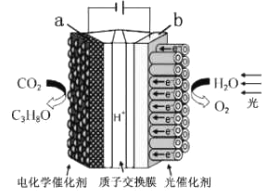
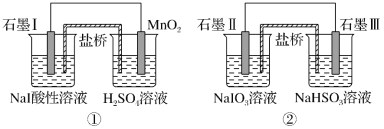
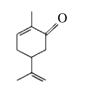
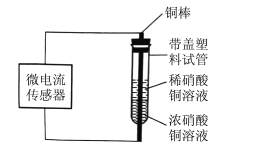
题目内容
【题目】有X、Y、Z三种元素,其中:X的负价阴离子核外电子排布和氙原子的核外电子排布相同;Y有两种氧化物,其水溶液呈强碱性,在Y的两种氧化物中,Y的质量分数分别是74.19%和58.79%,这两种氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入Z单质的水溶液,溶液由无色变为深黄色。Z和X在同一主族,相差2个周期。试回答:
(1)写出三种元素的名称:X_________,Y________,Z_________ 。
(2)两种氧化物分别为_________和___________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,其离子方程式为(并标明电子转移方向和数目)_________
(4)X与Y形成的化合物比Z与Y 形成的化合物熔点:________(“高”或“低”)其原因是________
【答案】碘 钠 氯 Na2O Na2O2  低 NaI、NaCl都是离子化合物,I-半径比Cl-半径大,NaI中离子键键长长,晶格能小
低 NaI、NaCl都是离子化合物,I-半径比Cl-半径大,NaI中离子键键长长,晶格能小
【解析】
X的负价阴离子核外电子排布和氙原子的核外电子排布相同,说明X为第五周期元素;Y有两种氧化物,其水溶液呈强碱性,在Y的两种氧化物中,Y的质量分数分别是74.19%和58.79%,这两种氧化物的摩尔质量分别是62g/mol和78g/mol,则为Na2O、Na2O2,Y为Na;在X和Y化合生成物的水溶液中滴入Z单质的水溶液,溶液由无色变为深黄色,生成单质碘,Z和X在同一主族,相差2个周期,Z为第三周期氯。
(1)根据上面分析得出三种元素的名称:X为碘,Y为钠,Z为氯;故答案为:碘;钠;氯。
(2)两种氧化物分别为Na2O和Na2O2;故答案为:Na2O;Na2O2。
(3)氯气和碘离子反应生成单质碘和氯离子,其离子方程式为:Cl2 + 2I- = 2 Cl-+ I2,双线法表示电子转移 ,故答案为:
,故答案为: 。
。
(4)NaI、NaCl都是离子化合物,I-半径比Cl-半径大,NaI中离子键键长长,晶格能小,NaI熔点比NaCl形成的化合物熔点低,其原因是NaI、NaCl都是离子化合物,I-半径比Cl-半径大,NaI中离子键键长长,晶格能小;故答案为:低;NaI、NaCl都是离子化合物,I-半径比Cl-半径大,NaI中离子键键长长,晶格能小。

 寒假学与练系列答案
寒假学与练系列答案