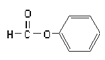
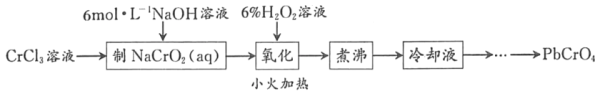
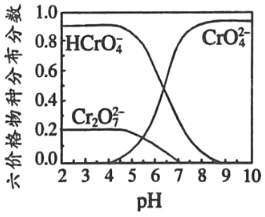
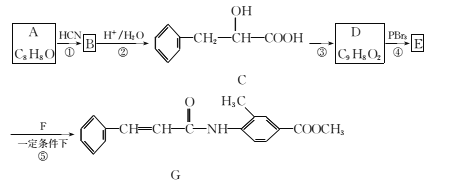
题目内容
【题目】在密闭容器中充入体积比为1∶1的CO2和CO的混合气体,这时测得容器内的压强为P1,若控制容器的体积不变,加入足量的Na2O2固体,不断用电火花燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2,则P1和P2之间的关系是
A.P1=8P2B.P1=4P2C.P1=2P2D.P1=P2
【答案】B
【解析】
CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2,2CO+O2=2CO2,相当于发生反应:CO+Na2O2=Na2CO3,根据反应前后的压强之比=反应前后的物质的量之比来计算。
设CO2的物质的量为x,则CO的物质的量也为x,CO2、CO与足量Na2O2的反应如下:2CO2+2Na2O2=2Na2CO3+O2 ①,2CO+O2=2CO2 ②,将①②叠加可得:CO+Na2O2=Na2CO3 ③,所以可以认为只发生了两个反应①和③,最后剩余气体就是CO2发生反应①生成的O2,n(O2)= ![]() ,反应前后的压强之比=反应前后的物质的量之比=2x:
,反应前后的压强之比=反应前后的物质的量之比=2x:![]() =4:1,所以P1=4P2;
=4:1,所以P1=4P2;
故选:C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目