题目内容
13.按下列要求回答下列问题(1)写出(NH4)2SO4溶于水时的电离方程式(NH4)2SO4=2NH4++SO42-
(2)写出下列化学反应方程式:
①(NH4)2SO4与氢氧化钠反应加热(NH4)2SO4+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O
②(NH4)2SO4与氯化钡反应(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl.
分析 (1))(NH4)2SO4强电解质,电离出铵根离子和硫酸根离子,强电解质在溶液中能完全电离用“=”;
(2)①铵盐和碱反应生成氨气;
②(NH4)2SO4与氯化钡发生复分解反应生成硫酸钡和氯化铵.
解答 解:(1)(NH4)2SO4强电解质,电离时电离出自由移动的铵根离子和硫酸根离子,(NH4)2SO4=2NH4++SO42-,
故答案为:(NH4)2SO4=2NH4++SO42-;
(2)①(NH4)2SO4与氢氧化钠反应生成硫酸钠、氨气和水,反应为:(NH4)2SO4+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O,
故答案为:(NH4)2SO4+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O;
②(NH4)2SO4与氯化钡发生复分解反应,反应方程式为:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl,
故答案为:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl.
点评 本题以氮的有关知识考查电离方程式、化学方程式的书写,注意强电解质在溶液中能完全电离,用“=”,化学方程式的书写注意反应原理,掌握氮及其化合物的性质是解答关键,题目难度不大.

练习册系列答案
相关题目
4.某温度下 H2(g)+I2(g)?2HI(g)的平衡常数K=O.25,该温度下在甲、乙、丙三个恒容密闭容器中充入H2(g)、I2(g),起始浓度如下表所示:
下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时甲中和丙中H2的转化率相同 | |
| B. | 平衡时乙中I2的转化率小于40% | |
| C. | 平衡时乙中c(HI)比甲中的2倍大 | |
| D. | 反应平衡时,丙中气体颜色最深,乙中气体颜色最浅 |
1.你认为下列说法不合理的是( )
| A. | 塑料制品长期不使用也会老化 | |
| B. | 可以通过与盐酸的互滴实验鉴别碳酸钠和碳酸氢钠 | |
| C. | 过氧化钠可以作供氧剂,可以和二氧化硫反应生成亚硫酸钠和氧气 | |
| D. | 纯碱是 Na2C03,小苏打是 NaHC03,其水溶液均呈碱性 |
18.下列反应中,水做氧化剂的是( )
| A. | SO3+H2O═H2SO4 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | 2F2+2H2O═4HF+O2 |
5.已知C2H4(g)和C2H5OH(l)的燃烧热分别是1411.0kJ/mol和1366.8 kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A. | -44.2kJ/mol | B. | +44.2kJ/mol | C. | -330kJ/mol | D. | +330kJ/mol |
2.图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |  B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 |  C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 |  D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法中正确的是( )
| A. | Cl-的摩尔质量是 35.5g/mol | B. | 98g H2SO4中含氧原子个数为NA | ||
| C. | 含NA个氢原子的H2O的质量是18 g | D. | 22.4 L 氦气的质量是 4g |




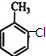
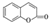 )是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下:
)是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下: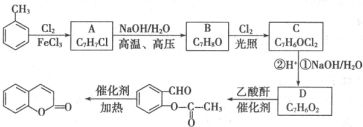
 ,D的结构简式是
,D的结构简式是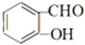 .
.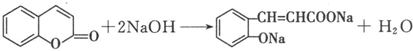 .
. .
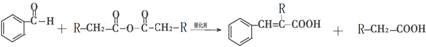
.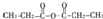 ,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是
,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是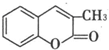 .
.