题目内容
醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.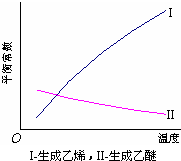
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃.试回答:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若在上述实验条件下,增大压强,平衡 (选填“正向”、“逆向”、“不”)移动;
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式 .当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是 .选择该温度区域的理由是 .

| 温度 (℃) |
乙醇转化率 (%) |
有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是
分析:(1)平衡移动的应用,考虑温度、压强对平衡的影响;
(2)从平衡常数的定义和意义入手;
(3)从表中数据找出温度和乙醚含量的关系.
(2)从平衡常数的定义和意义入手;
(3)从表中数据找出温度和乙醚含量的关系.
解答:解:(1)从表中数据可看出,升高温度,乙醇的转化率升高,根据升高温度平衡向吸热反应方向移动,所以乙醇制取乙烯为吸热反应;
增大压强,平衡向体积减小方向移动,因正反应为体积增大的方向,故平衡逆向移动,
故答案为:吸热;逆向;
(2)乙醇制取乙醚的反应方程式为:2C2H5OH
C2H5OC2H5+H2O,故平衡常数为K=
,K值越大,表示该反应向正方向进行的程度越大,乙醇的转化率越高,反应进行得越完全,
故答案为:K=
; AB;
(3)乙醚产量应同时考虑乙醇的转化率和乙醚的含量.由表知,155℃时乙醇催化脱水制取的乙醚产量大于135℃时,乙醇制乙醚合适的反应温度区域是 135~155℃,温度太低,化学反应速率小,且乙醇的转化率低,温度太高,乙醚的含量太低,
故答案为:135~155℃;温度太低,化学反应速率小,且乙醇的转化率低,温度太高,乙醚的含量太低.
增大压强,平衡向体积减小方向移动,因正反应为体积增大的方向,故平衡逆向移动,
故答案为:吸热;逆向;
(2)乙醇制取乙醚的反应方程式为:2C2H5OH
| 加热 |
| c(C2H5OC2H5)?c(H2O) |
| c2(C2H5OH) |
故答案为:K=
| c(C2H5OC2H5)?c(H2O) |
| c2(C2H5OH) |
(3)乙醚产量应同时考虑乙醇的转化率和乙醚的含量.由表知,155℃时乙醇催化脱水制取的乙醚产量大于135℃时,乙醇制乙醚合适的反应温度区域是 135~155℃,温度太低,化学反应速率小,且乙醇的转化率低,温度太高,乙醚的含量太低,
故答案为:135~155℃;温度太低,化学反应速率小,且乙醇的转化率低,温度太高,乙醚的含量太低.
点评:本题考查了影响平衡的因素,平衡常数问题的计算.读懂图中数据是关键,对于平衡常数计算,依据概念写出写出表达式.

练习册系列答案
相关题目
(10分)
Ⅰ醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
 |
![]()
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若增大压强,平衡
(选填 “正向”、“逆向”、“不”)移动。
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式K= 。
当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(3)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量 (选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是 。
Ⅱ水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,而后用酸去除。从CaSO4到CaCO3的沉淀转化中,并存在着两个沉淀溶解平衡,
写出前一个沉淀溶解平衡表达式:
已知Ksp(CaCO3) =2.8×10-9 mol2/L2 ,将136gCaSO4固体加入1L Na2CO3溶液中,待沉淀转化后,溶液中c(CO32-) = 0.001mol/L。计算Ksp(CaSO4) = mol2/L2
(忽略溶液体积变化)
 (2009?惠州二模)醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
(2009?惠州二模)醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.

 (8分)醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
(8分)醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。