题目内容
5.NA代表阿伏加德罗常数,下列有关叙述正确的是( )| A. | 1mol苯分子中含有碳碳双键数为3NA | |
| B. | 1mol氯化氢分子中含H+离子数为NA | |
| C. | 16 gCH4与18g NH4+ 所含质子数均为NA | |
| D. | 4.6 g钠与足量盐酸完全反应失去电子数为0.2NA |
分析 A.苯分子中的碳碳键为一种介于单键和双键之间的独特键;
B.氯化氢为共价化合物,氯化氢分子中不存在氢离子;
C.甲烷中含有10个质子,铵根离子中含有11个电子;
D.根据n=$\frac{m}{M}$计算出钠的物质的量,钠为+1价金属,再计算出转移的电子数.
解答 解:A.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故A错误;
B.氯化氢属于共价化合物,所以氯化氢分子中只存在分子,不存在氢离子,故B错误;
C.16gCH4的物质的量为1mol,含有10mol质子;18gNH4+的物质的量为1mol,含有11mol质子,二者含有的质子数不同,故C错误;
D.4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,0.2mol钠与足量盐酸完全反应失去0.2mol电子,失去电子数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的关系,A为易错点,需要明确苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列叙述不正确的是( )
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 氧化还原反应的本质是电子的得失或偏移 | |
| C. | 臭氧与氧气结构不同,二者之间的转化是氧化还原反应 | |
| D. | Cl-、I-、S2-等只有还原性,但也有不少阴离子有较强的氧化性 |
16.下列说法正确的是( )
| A. | 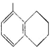 所有碳原子可能在同一平面上 所有碳原子可能在同一平面上 | |
| B. | 化合物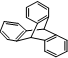 是苯的同系物 是苯的同系物 | |
| C. | 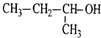 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| D. | 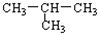 与CH3-CH2-CH2-CH3互为同分异构体 与CH3-CH2-CH2-CH3互为同分异构体 |
13.现有含NaCl、Na2SO4 和NaNO3 的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl- 和NO3- 的相互分离.相应的实验过程如下:
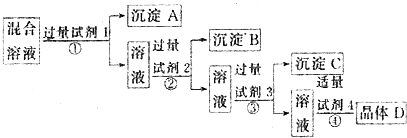
下列关于四种试剂顺序正确的是( )

下列关于四种试剂顺序正确的是( )
| A. | 氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液 | |
| B. | 硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液 | |
| C. | 氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液 | |
| D. | 硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液 |
20.甲苯结构中若有两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物中具有酸性的同分异构体有( )
| A. | 9种 | B. | 10种 | C. | 13种 | D. | 17种 |
10.NA表示阿伏加德罗常数的值.下列判断中,正确的是( )
| A. | H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子 | |
| B. | SO2和CO2都属于酸性氧化物,Na2O和A12O3都属于碱性氧化物 | |
| C. | 在氯化铵水溶液中,既存在水解平衡,又存在电离平衡 | |
| D. | O2在放电的条件下生成O3属于化学变化,电解质溶液导电属于物理变化 |
17. “砳砳”(音:lèlè乐乐)是2014年第二届夏季青年奥林匹克运动会吉祥物(如图),制作它的外部材料为纯羊毛绒,内充无毒的合成纤维.下列说法正确的是( )
“砳砳”(音:lèlè乐乐)是2014年第二届夏季青年奥林匹克运动会吉祥物(如图),制作它的外部材料为纯羊毛绒,内充无毒的合成纤维.下列说法正确的是( )
 “砳砳”(音:lèlè乐乐)是2014年第二届夏季青年奥林匹克运动会吉祥物(如图),制作它的外部材料为纯羊毛绒,内充无毒的合成纤维.下列说法正确的是( )
“砳砳”(音:lèlè乐乐)是2014年第二届夏季青年奥林匹克运动会吉祥物(如图),制作它的外部材料为纯羊毛绒,内充无毒的合成纤维.下列说法正确的是( )| A. | 制作“砳砳”的内充物是引起白色污染的主要物质 | |
| B. | 纯羊毛和合成纤维可用燃烧法区别 | |
| C. | 制作“砳砳”的外部材料属于有机合成材料 | |
| D. | 合成纤维的吸水性和透气性比纯羊毛好 |
14.向盛有一定质量的NaCl和Na2SO4固体混合物的烧杯中加水,固体完全溶解后,再加入一定质量分数的BaCl2溶液至恰好完全反应,过滤烘干得到23.3g沉淀,经测定滤液中含有氯元素的质量为21.3g(不考虑过程中物质质量的损失),计算原固体混合物中NaCl的质量为( )
| A. | 5.85g | B. | 11.7g | C. | 14.2g | D. | 23.4g |
15. 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )| A. | CaF2 | B. | CaO2 | C. | CaC2 | D. | Na2O2 |