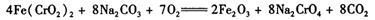题目内容
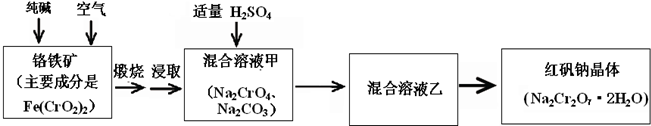
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2→ 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
上述反应中不属于氧化还原反应有 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目: 。
某厂废水中含1.00×10?3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。
2 (1分) c d (2分)
 2.78克(2分)
2.78克(2分)
【解析】
试题分析:(1)凡是有元素化合价升降的反应都是氧化还原反应,据此可知,只有反应Ⅰ是氧化还原反应,其余2个都不是的。Fe(CrO2)2中铬元素是+3价,则铁元素的化合价是+2价,反应后铁元素的化合价升高到+3价,Cr元素的化合价升高到+6价,所以被氧化的元素有铁和Cr,a不正确;氧气得到电子,所以氧化剂与还原剂的物质的量之比为7:4,b不正确;根据方程式可知,每生成8molCO2,转移7mol×4=28mol电子,所以每生成1molCO2,转移28mol÷8=3.5mol电子,c正确;Cr的化合价从+3价升高到+6价,失去3个电子,氧气得到4个电子,所以每摩尔+3的Cr能还原3mol÷4=0.75mol氧气,d正确,答案选cd。
(2)有Cr3+、Fe3+生成,说明Cr2O72-是氧化剂,绿矾是还原剂,则反应的化学方程式是
 。
。
(3)根据化合物中正负价代数和0可知,Cr0.5Fe1.5FeO4,+3价和+2价铁的个数之比是3:2。1L该废水中的Cr2O72-的物质的量是1.00×10?3mol,可以生成4.00×10?3mol Cr0.5Fe1.5FeO4,所以根据铁原子守恒可知,需要绿矾的物质的量是4.00×10?3mol×2.5,其质量是1.00×10?2mol×278g/mol=2.78g。
考点:考查氧化还原反应的判断、表示和计算
点评:该题以废水中重铬酸钠的净化为载体,主要是考查学生对氧化还原反应概念、判断、表示以及有关计算的熟悉了解程度,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的环境保护意识和应试能力。