题目内容
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液,试计算所得溶液中硫酸锌的物质的量浓度和溶质质量分数各是多少?
解:6.5gZn的物质的量为 =0.1mol,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为
=0.1mol,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为 =1.25mol/L;
=1.25mol/L;
ZnSO4的质量为0.1mol×161g/mol=16.1g,溶液的质量为80mL×1.25g/mL=100g,gu 所得反应中硫酸锌的质量分数为 ×100%=16.1%,
×100%=16.1%,
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L,溶质质量分数为16.1%
分析:根据n= 计算6.5gZn的物质的量,根据Zn元素计算生成的n(ZnSO4),根据c=
计算6.5gZn的物质的量,根据Zn元素计算生成的n(ZnSO4),根据c= 计算ZnSO4的物质的量浓度;
计算ZnSO4的物质的量浓度;
根据m=nM计算ZnSO4的质量,根据m=ρV计算溶液的质量,根据溶质质量分数=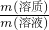 ×100%计算所得反应中硫酸锌的质量分数.
×100%计算所得反应中硫酸锌的质量分数.
点评:本题考查物质的量浓度、质量分数的有关计算,比较基础,注意对公式的理解与灵活运用.
 =0.1mol,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为
=0.1mol,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为 =1.25mol/L;
=1.25mol/L;ZnSO4的质量为0.1mol×161g/mol=16.1g,溶液的质量为80mL×1.25g/mL=100g,gu 所得反应中硫酸锌的质量分数为
 ×100%=16.1%,
×100%=16.1%,答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L,溶质质量分数为16.1%
分析:根据n=
 计算6.5gZn的物质的量,根据Zn元素计算生成的n(ZnSO4),根据c=
计算6.5gZn的物质的量,根据Zn元素计算生成的n(ZnSO4),根据c= 计算ZnSO4的物质的量浓度;
计算ZnSO4的物质的量浓度;根据m=nM计算ZnSO4的质量,根据m=ρV计算溶液的质量,根据溶质质量分数=
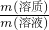 ×100%计算所得反应中硫酸锌的质量分数.
×100%计算所得反应中硫酸锌的质量分数.点评:本题考查物质的量浓度、质量分数的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目