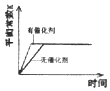
��Ŀ����
����Ŀ��ͨ���Ѷ���1molij��ѧ�������յ�������Ϊ���ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ���Թ��㻯ѧ��Ӧ�ķ�Ӧ��(����H��ʾ�����ȷ�Ӧ����H<0�����ȷ�Ӧ����H>0)����H=��Ӧ���ܼ���-�������ܼ��ܡ�
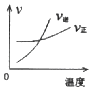
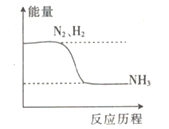
��֪��N��N����H-H����N-H�������ֱܷ����a��b��c(��λ��kJ��mol-1)�ϳɰ���Ӧ�������仯��ϵ��ͼ��ʾ��
�ش�����������
��1������1molNH3Ҫ___________(���������������ų���)����________(�ú�a��b��c�Ĵ���ʽ��ʾ)kJ��
��2��NH3�ֽ�����N2��1molH2Ҫ_________(���������������ų���)����____________(�ú�a��b��c�Ĵ���ʽ��ʾ)kJ��
��3����ʵ������Ӧ��������С������ֵ��ԭ�������_____________________��
���𰸡� �ų� ![]() ����
���� ![]() ��Ӧ����֡�������ʧ��(������������)
��Ӧ����֡�������ʧ��(������������)
����������1������ͼ���֪��Ӧ����������������������������Ӧ�Ƿ��ȷ�Ӧ�����ݷ���ʽN2��3H2![]() 2NH3��֪����1molNH3�ų���������
2NH3��֪����1molNH3�ų���������![]() kJ����2���������Ϸ�����֪NH3�ֽ�����N2��1molH2Ҫ���յ�����Ϊ
kJ����2���������Ϸ�����֪NH3�ֽ�����N2��1molH2Ҫ���յ�����Ϊ![]() kJ����3�������ǿ��淴Ӧ���һ���������ʧ����˷�Ӧ��������С������ֵ��
kJ����3�������ǿ��淴Ӧ���һ���������ʧ����˷�Ӧ��������С������ֵ��

����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�صļ����Ӷ�����10���������Ҷ�ӦԪ�ػ��ϼ���ԭ�������Ĺ�ϵ��ͼ��ʾ��

��1����A��E����Ԫ�ص�Ԫ�ط��������±�����ȷ��λ���ϡ�________
������ ���� | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
һ | ||||||||
�� | ||||||||
�� | ||||||||
��2��A��B��C��D��E��F����Ԫ���зǽ�������ǿ����____________(��Ԫ�ط���)��B��D��Ԫ�ؿ������ԭ�Ӹ�����Ϊ1��1�����ӻ����д�������ӻ�����ĵ���ʽ��______��A��B��Ԫ�ض�Ӧ����̬�⻯����ȶ���ǿ����ϵ��________________(�û�ѧʽ��ʾ)��
��3��д��D��F��Ԫ�ص�����������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ��________________________