题目内容
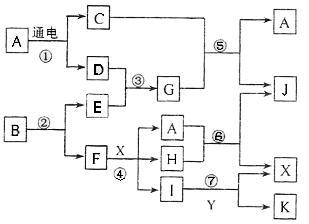
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝 酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:A.________,E._________,F._________,Y._________。
(2)反应⑤的化学方程式为____________________。
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为________。
![]()
解析:此题目在题干部分给出了一部分条件,而根据这部分条件可以推断出G为NH3,Y为HCl,K可能为AgCl或BaSO4,再根据框图中I与Y(即HCl)反应生成K,可知K为AgCl,X为一种酸。A为一种无色液体且电解时只产生两种产物,推知A为H2O,电解产物为H2和O2(即C和D),又知D可与E化合生成G(NH3),因此D为H2,E为N2,C为O2。则反应⑤为NH3与O2反应生成NO和H2O的反应,是工业制硝酸的主要反应之一,因此X为硝酸,J为NO,I为AgNO3。再看反应⑥A(H2O)+H J(NO)+
X(HNO3),很容易推断出H为NO2。在反应④中,F与硝酸反应生成硝酸银、NO2和水,可以推断F为Ag。但是B通过反应②可以获得N2和Ag,根据题干暂时无法推出B究竟是什么物质,可以根据提问(3)的提示判断,1 mol B中含有1 mol Ag,再根据其所占的质量分数计算即可得出B的化学式为AgN3。
答案:(1)H2O N2 Ag HCl(2)4NH3+5O2![]() 4NO+6H2O(3)AgN3
4NO+6H2O(3)AgN3

练习册系列答案
相关题目

 请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。