题目内容
标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2和CO的质量和体积各为多少?
解:n(H2)+n(CO)=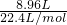 =0.4mol,
=0.4mol,
n(H2)×2g/mol+(0.4mol-n(H2))×28g/mol=6.0g,
n(H2)=0.2mol,
n(CO)=0.4mol-0.2mol=0.2mol,
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.2mol×28g/mol=5.6g,
V(CO)=V(H2)=0.2mol×22.4L/mol=4.48L,
答:此混合气体中H2和CO的质量分别为m(H2)=0.4g,m(CO)=5.6g;V(CO)=V(H2)=4.48L.
分析:根据气体的体积和质量可列方程式计算相关物理量.
点评:本题考查混合物的计算,题目难度不大,注意相关物理量的计算公式的运用.
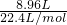 =0.4mol,
=0.4mol,n(H2)×2g/mol+(0.4mol-n(H2))×28g/mol=6.0g,
n(H2)=0.2mol,
n(CO)=0.4mol-0.2mol=0.2mol,
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.2mol×28g/mol=5.6g,
V(CO)=V(H2)=0.2mol×22.4L/mol=4.48L,
答:此混合气体中H2和CO的质量分别为m(H2)=0.4g,m(CO)=5.6g;V(CO)=V(H2)=4.48L.
分析:根据气体的体积和质量可列方程式计算相关物理量.
点评:本题考查混合物的计算,题目难度不大,注意相关物理量的计算公式的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
判断下列说法是否正确:
| A.1mol任何气体的体积都是22.4L( ) |
| B.标准状况下,1mol任何物质所占有的体积都约是22.4L( ) |
| C.标准状况下,1mol任何气体的体积都约是22.4L ( ) |
| D.标准状况下,1L H2和1L水的物质的量相同 ( ) |