题目内容
下图是某工厂对海水资源进行综合利用的示意图。

请回答下列问题:
(1)请列举一种海水淡化的方法 。
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 。
(3)侯氏制碱法中向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入 (填化学式),理由是 。再由NaHCO3制得纯碱,化学方程式为 。
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取。已知有关物质的熔沸点数据如下:
| MgO | MgCl2 |
熔点/℃ | 2 852 | 714 |
沸点/℃ | 3 600 | 1 412 |
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 。
【答案】
(1)蒸馏法(或电渗析法、冷冻法、离子交换法等)
(2)Na+ 阴极 2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(3)NH3 NH3极易溶于水,有利于充分吸收CO2,增大溶液中碳酸氢根的浓度 2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(4)MgO比MgCl2熔点高,电解MgO比电解MgCl2耗能多
【解析】(2)离子交换膜电解饱和食盐水,只有Na+通过离子交换膜,阴极H+得电子生成氢气,阴极区溶液中OH-浓度增大

练习册系列答案
相关题目
【化学--选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
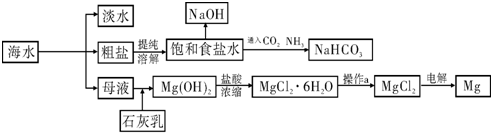
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 .
下图是某工厂对海水资源进行综合利用的示意图.

请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |


