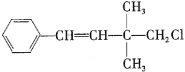
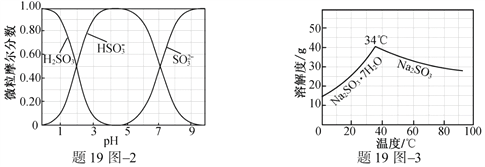
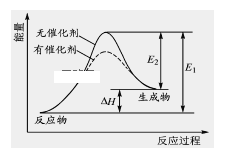
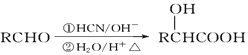题目内容
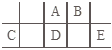
【题目】进行下面的实验要用到下列一种仪器,请用这些仪器的名称填空。
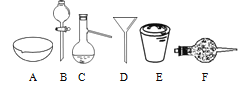
(1)欲干燥Cl2需使用仪器______;
(2)欲分离互不相溶的两种液体,可使用______;
(3)欲分离液态混合物中沸点不同的组分,可使用______;
(4)欲分离悬浮于液体中的固体物质,可使用______;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用______。
(6)欲从食盐水中获得食盐晶体,可使用______。
【答案】干燥管 分液漏斗 蒸馏烧瓶 漏斗 坩埚 蒸发皿
【解析】
(1)干燥Cl2用无水氯化钙,无水氯化钙属于固体干燥剂,应该盛放在干燥管中,所以欲干燥Cl2需使用仪器为球形干燥管;
(2)分液漏斗用于分离互不相溶的两种液态物质,则欲分离互不相溶的两种液态物质,须使用分液漏斗;
(3)蒸馏烧瓶用于分离互溶的、沸点不同的液态混合物,则欲分离互溶的、沸点不同的液态混合物,须使用蒸馏烧瓶和酒精灯;
(4)漏斗用于分离不溶固体和液体混合物,欲分离悬浮于液体中的固体物质,可使用漏斗;
(5)加热固体,应在坩埚中进行,欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用坩埚。
(6)从含固体溶质的溶液中除去溶剂可用蒸发,欲从食盐水中获得食盐晶体,可使用蒸发皿。

【题目】已知测定中和热的实验步骤如下:
![]() 量取50mL
量取50mL![]() 硫酸倒入小烧杯中,测量温度;
硫酸倒入小烧杯中,测量温度;
![]() 量取50mL
量取50mL![]() NaOH溶液,测量温度;
NaOH溶液,测量温度;
![]() 将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)![]() 溶液稍过量的原因______.
溶液稍过量的原因______.
(2)加入NaOH溶液的正确操作是______![]() 填字母
填字母![]() .
.
A.沿玻璃棒缓慢加入![]() 一次迅速加入
一次迅速加入![]() 分三次加入
分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______.
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
| NaOH | 平均值 | |||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
(4)设溶液的密度均为![]() ,中和后溶液的比热容
,中和后溶液的比热容![]() ,请根据实验数据求出中和热为______写出该反应的热化学方程式______
,请根据实验数据求出中和热为______写出该反应的热化学方程式______
(5)若将含![]()
![]() 的浓硫酸与含1molNaOH的溶液混合,放出的热量______
的浓硫酸与含1molNaOH的溶液混合,放出的热量______![]() 填“小于”、“等于”或“大于”
填“小于”、“等于”或“大于”![]() ,原因是______.
,原因是______.
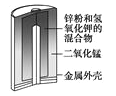
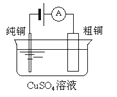
【题目】下列有关四个常用电化学装置的叙述中,正确的是![]()
![]()
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ氢氧燃料电池 |
A. 图Ⅰ所示电池中,MnO2是正极,电极反应式是2H2O+2e-=H2↑+2OH-
B. 图Ⅱ所示电池放电过程中,当外电路通过1mol电子时,理论上负极板的质量增加96g
C. 图Ⅲ所示装置工作过程中,阳极质量减少量等于阴极的质量增加量
D. 图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池的总反应式不变