题目内容
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
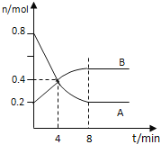
(1)该反应的化学方程式为________________;
(2)前4分钟,A的速率为__________________,平衡时A的转化率是_________
(3)第4min时,正、逆反应速率的大小关系为:v (正)__ v (逆);(填“>”、“<”或“=”)
(4)以下措施能加快反应速率的是___________。
A 恒温恒容充入He使压强增大 B 缩小体积,使压强增大
C 恒温恒压充入He D 平衡后加入催化剂
(5)下列叙述能说明该反应已达到化学平衡状态的是________。
A 容器内压强不再发生变化
B A的体积分数不再发生变化
C 容器内气体原子总数不再发生变化
D 相同时间内消耗2n molA的同时生成n mol B
【答案】2A![]() B 0.2mol/(L·min) 75﹪ > BD AB
B 0.2mol/(L·min) 75﹪ > BD AB
【解析】
由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至4min时,A减少0.8mol-0.4mol=0.4mol,B增加0.4mol-0.2mol=0.2mol,结合反应速率之比等于化学计量数之比、v=![]() 计算,且第8min时A、B的物质的量不再变化,达到平衡状态,以此来解答。
计算,且第8min时A、B的物质的量不再变化,达到平衡状态,以此来解答。
(1)由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至4min时,A减少0.8mol-0.4mol=0.4mol,B增加0.4mol-0.2mol=0.2mol,由反应速率之比等于化学计量数之比可知,A、B的化学计量数比为2:1,且后来达到平衡状态,则反应为2A![]() B;
B;
(2)反应开始至4min时,A的平均反应速率为 =0.2mol/(L·min) ;平衡时A的物质的量为0.2mol,则A的转化率为
=0.2mol/(L·min) ;平衡时A的物质的量为0.2mol,则A的转化率为![]() =75%;
=75%;
(3)第4min时,反应尚未达到平衡,仍向正反应方向进行,则正、逆反应速率的大小关系为:v (正)> v (逆);
(4)A.恒温恒容充入He使压强增大,但不改变反应物和生成物的浓度,不影响反应速率,故A错误;
B.缩小体积,使压强增大,反应物和生成物的浓度均瞬间增大,反应速率加快,故B正确;
C.恒温恒压充入He,容积增大,反应物和生成物的浓度均瞬间减小,反应速率减慢,故C错误;
D.平衡后加入催化剂,可加快反应速率,故D正确;
故答案为BD;
(5)A.在怛温恒容条件下,容器内压强不再发生变化,说明气体的物质的量不变,反应达平衡状态,故A正确;
B.A的体积分数不再发生变化,说明气体的各物质的量不变,反应达平衡状态,故B正确;
C.依据质量守恒定律,容器内气体原子总数一直不变化,则无法判断是否为平衡状态,故C错误;
D.相同时间内消耗2n molA的同时生成n mol B,均体现正反应速率,无法判断是平衡状态,故D错误;
故答案为AB。

 阅读快车系列答案
阅读快车系列答案